
【题目】屠呦呦1971年发现、分离、提纯并用于治疟新药“青蒿素”,救了数千万人的生命,青蒿素分子结构如图.下列有关说法正确的是( ) 
A.青蒿素可溶于乙醚和水
B.青蒿素的晶体为分子晶体,化学式为C16H20O5
C.青蒿素与NaOH溶液不反应
D.青蒿素含有过氧键,一定条件下有氧化性
科目:高中化学 来源: 题型:
【题目】已知:4NH3+5O2=4NO+6H2O,若反应速率分别用ν(NH3)、ν(O2)、ν(NO)、ν(H2O)(摩/升分)表示,则正确的关系是( )
A.![]() ν(NH3)=ν(O2)
ν(NH3)=ν(O2)
B.![]() ν(O2)=ν(H2O)
ν(O2)=ν(H2O)
C.![]() ν(NH3)=ν(H2O)
ν(NH3)=ν(H2O)
D.![]() ν(O2)=ν(NO)
ν(O2)=ν(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向59.2g Fe2O3和FeO的混合物中加入某浓度的稀硝酸1.0L,固体物质完全反应,生成NO和Fe(NO3)3。在所得溶液中加入1.0mol/L的NaOH溶液2.8L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为85.6g。下列有关说法错误的是 ( )
A. Fe2O3和FeO的物质的量之比为1:6
B. 硝酸的物质的量浓度为3.0mol/L
C. 产生的NO在标准状况下的体积为4.48L
D. Fe2O3和FeO与硝酸反应后剩余0.2molHNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度相同,浓度均为0.2molL﹣1的①(NH4)2SO4 , ②NaNO3 , ③NH4HSO4 , ④NH4NO3 , ⑤CH3COONa溶液,它们的pH由小到大的排列顺序是( )
A.③①④②⑤
B.①③⑤④②
C.③②①⑤④
D.⑤②④①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
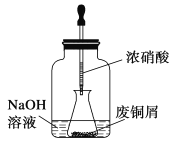
步骤一:废铜屑制硝酸铜
如图,用胶头滴管吸取浓硝酸缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。
步骤二:碱式碳酸铜的制备
向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70 ℃左右,用0.4 mol·L-1的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。
完成下列填空:
(1)写出浓硝酸与铜反应的离子方程式___________________________________________。
(2)上图装置中NaOH溶液的作用是_________________________。
(3)步骤二中,水浴加热所需仪器有________、________(加热、夹持仪器、石棉网除外),水浴加热的优点是_______________________。
(4) 已知:CuCO3、Cu(OH)2受热均易分解,产物中都有CuO生成。碱式碳酸铜可表示为xCuCO3·yCu(OH)2·zH2O(x、y、z取整数),测定碱式碳酸铜组成的方法有多种,现采用氢气还原法,请回答如下问题:(已知M(Cu)=63.5 g·mol-1)。
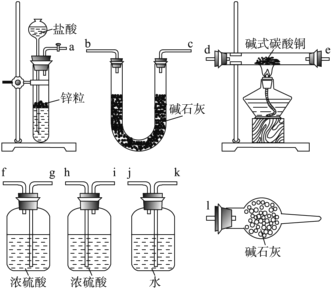
①写出xCuCO3·yCu(OH)2·zH2O与氢气反应的化学方程式:__________________;
②实验装置用上面所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):( a )→( )( )→( )( )→( )( )→( )( )→( )( )→( l )_____
③称取23.9 g某碱式碳酸铜样品,充分反应后得到12.7 g残留物,生成4.4 g二氧化碳和7.2 g水。该样品的结晶水质量为______ g,化学式为____________。
④某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?__________(填“可行”或“不可行”)请说明理由________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是 ( )
A. Mg2+、Na+、SO42-、Cl-B. Ba2+、K+、HCO3-、NO3-
C. Na+、K+、OH-、Cl-D. Na+、Cu2+、SO42-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】限用硫酸、盐酸、醋酸、钠盐、钾盐在溶液中反应,符合离子方程式2H++CO32-===H2O+CO2↑的化学方程式的个数有( )
A. 3B. 5C. 8D. 12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请按要求回答有关问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
1 | ① | … | |||||||
2 | … | ② | ③ | ④ | |||||
3 | ⑤ | … | ⑥ | ⑦ | ⑧ | ⑨ | |||
4 | … | ⑩ |
(1)④、⑤、⑥的原子半径由大到小的顺序是________(用元素符号表示)
(2)②、⑦两种元素最高价氧化物对应的水化物中酸性最强的是 ______(用化学名称表示),能证明以上结论的化学方程式是 ______________________________________
(3)第三周期元素形成的简单离子中半径最小的微粒是_____(用离子符号表示),写出⑥元素的单质与⑤最高价氧化物对应的水化物反应的离子方程式____________________。
(4)元素③、⑧的氢化物中,沸点较低的物质的结构式是_____; 请简述理由_______________。
(5)①、③、④、⑥元素可形成含10个电子的微粒,其中A和B为分子,C和E为阳离子,D为阴离子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。用电子式表示下列4种微粒。
A________、B________、C________、D________。
(6)⑨元素与⑩元素两者核电荷数之差是 ____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
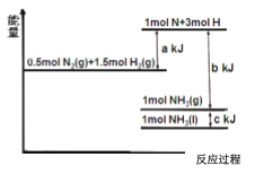
【题目】I、根据能量变化示意图,请写出氮气和氢气合成液态 的氨气的热化学方程式_____;
Ⅱ、已知:NO2(g)+ SO2(g)![]() SO3(l)+ NO(g)ΔH=-51.5kJ·mol-1
SO3(l)+ NO(g)ΔH=-51.5kJ·mol-1
若在一定条件下,将 NO2 与 SO2 以体积比 1:2 置于恒容密闭容器 中发生上述反应,
①下列能说明反应达到平衡状态的是_____。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3 和 NO 的物质的量之比保持不变 d.每消耗 1 mol SO3 的同时生成 1 molNO2
e.容器内气体密度不变
②恒容密闭容器中发生上述反应时,若加入 Ar 气,反 应速率_____(变大、变小或不变)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com