
【题目】用图中所示的装置进行实验,实验现象和预测不一致的是 ( )
| ①中的物质 | ②中的物质 | 预测现象 | |
A | 浓氨水 | FeCl3溶液 | ②中有红褐色沉淀 | |
B | 浓氨水 | 浓盐酸 | ③中有白烟 | |
C | 饱和氯水 | Na2S溶液 | ②中生成淡黄色沉淀 | |
D | 饱和亚硫酸 | 蓝色石蕊试液 | ②中溶液先变红后褪色 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是( )
A.16gO2和O3的混合气体中含有的分子数为0.5NA
B.0.3molAgNO3受热完全分解(2AgNO3=2Ag+2NO2↑+O2↑),用排水法收集到气体的分子数为 0.25NA
C.0.5NA个氯气分子所占体积约是11.2L
D.2.3g金属钠在装有氧气的集气瓶中完全燃烧,转移的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求完成下列各题:
(1)质量都是50 g的 HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是__________
(2)某溶液中只含有Na+、Al3+、Cl-、SO42-四种离子,已知前三种离子的个数比为1∶2∶1, 则溶液中Al3+和SO42-的离子个数比为__________。
(3)将一小块钠投入到盛CuSO4溶液的烧杯中,剧烈反应,放出气体并生成蓝色沉淀,其总反应的离子方程式为________________。
(4)将FeSO4溶液与过量NaOH溶液混合并在空气中放置一段时间,整个过程中的现象为______,反应过程分两步,其中第2步反应的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室中称取20gNaOH固体,配制500mL1mol·L-1的氢氧化钠溶液。
(1)该同学准备的实验用品有:托盘天平![]() 带砝码
带砝码![]() 、药匙、量筒、玻璃棒等,还缺少的玻璃仪器有__、__、___。
、药匙、量筒、玻璃棒等,还缺少的玻璃仪器有__、__、___。
(2)下列有关实验操作,正确的是__。(多选)
A.称量氢氧化钠固体时,应该放在称量纸上称量
B.某同学将称量的氢氧化钠固体溶解并冷却至室温,然后转移到容量瓶中
C.某同学在定容时,不小心加水超过刻度线,又将多余的液体吸出直至刻度线
D.某同学在溶解、转移完氢氧化钠溶液后,将溶解用的仪器洗涤2~3次,并将洗涤液转移到容量瓶中
(3)玻璃棒在该实验中的作用有①__,②___。
(4)若实验室遇到下列情况,对氢氧化钠溶液的物质的量浓度有何影响![]() 填“偏高”、“偏低”或“无影响”
填“偏高”、“偏低”或“无影响”![]()
①转移时,有少量的溶液洒落出容量瓶__。
②定容时,容量瓶中事先有洁净的蒸馏水,所配溶液的浓度___。
③定容时俯视溶液的凹液面___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2 mol·L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。
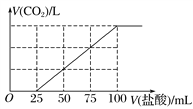
下列判断正确的是( )
A. 通入CO2在标准状况下的体积为448 mL
B. 原NaOH溶液的浓度为0.2 mol·L-1
C. 所得溶液的溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶3
D. 所得溶液的溶质成分的物质的量之比为n(NaHCO3)∶n(Na2CO3)=1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Na2FeO4溶液氧化废水中的还原性污染物M,为研究降解效果,设计如下对比实验探究温度、浓度、 pH、催化剂对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示:
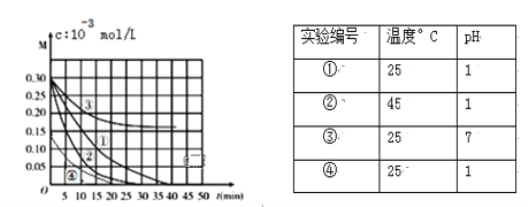
下列说法正确的是
A. 实验①在15 min内M的降解速率为1.33×10-2mol/(L·min)
B. 若其他条件相同,实验①②说明升高温度,M降解速率增大
C. 若其他条件相同,实验①③证明pH越高,越有利于M的降解
D. 实验②④说明M的浓度越小,降解的速率越慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《我不是药神》中的“格列宁”是一种抗癌药。同样是抗癌药物"6-Azulenol”的结构简式如图所示,下列有关叙述错误的是 ( )
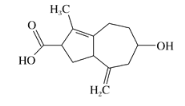
A.分子式为C13H18O3
B.能发生加成、氧化、酯化反应
C.能使溴水、酸性高锰酸钾溶液褪色
D.1mol该物质与足量的Na反应可产生11.2LH2(已换算成标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯腈(CH2=CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH2=CHCHO)和乙腈(CH3CN)等,回答下列问题:
(1)用于生产丙烯腈的原料丙烯具有一定的危险性。某市化工园区曾发生一起丙烯储罐突然爆炸起火事件,大火产生的高温使消防队员难以靠近火场。已知丙烯的燃烧热为2049 kJ/mol,则其燃烧反应的热化学方程式为:____________________。
(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应温度为460℃。低于460℃时,丙烯腈的产率________(填“是”或者“不是”)对应温度下的平衡产率,判断理由是_____________________;高于460℃时,丙烯腈产率降低的可能原因是________(双选,填标号)
A.催化剂活性降低 B.平衡常数变大 C.副反应增多 D.反应活化能增大
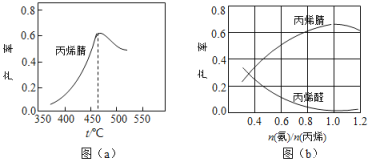
(3)丙烯腈和丙烯醛的产率与![]() 的关系如图(b)所示。由图可知最佳
的关系如图(b)所示。由图可知最佳![]() 约为________,理由是___________________。进料气氨、空气、丙烯的理论体积比约为________。
约为________,理由是___________________。进料气氨、空气、丙烯的理论体积比约为________。
(4)现以丙烯为原料,合成环状酯J。有关工艺流程图如下。已知:烯烃复分解反应是指在催化剂作用下,实现碳—碳双键两边基团换位的反应。如两个丙烯分子进行烯烃换位,生成丁烯和乙烯。
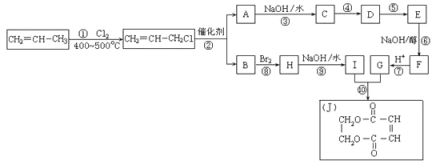
参考化学方程式:2CH2=CHCH3![]() CH3CH=CHCH3+CH2=CH2
CH3CH=CHCH3+CH2=CH2
i.①的反应类型是_____________,物质E的结构简式是___________。
ii.有机化合物C有多种同分异构体,请写出其中属于酯类且能发生银镜反应的所有同分异构体的结构简式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氧化还原反应中,实际参加反应的氧化剂与还原剂的物质的量之比正确的是( )
①KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O;1∶6
②3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;2∶3
③SiO2+3C![]() SiC+2CO↑;1∶2
SiC+2CO↑;1∶2
④3NO2+H2O=2HNO3+NO;2∶1
A.①③B.②③
C.②④D.①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com