
【题目】丙烯腈(CH2=CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH2=CHCHO)和乙腈(CH3CN)等,回答下列问题:
(1)用于生产丙烯腈的原料丙烯具有一定的危险性。某市化工园区曾发生一起丙烯储罐突然爆炸起火事件,大火产生的高温使消防队员难以靠近火场。已知丙烯的燃烧热为2049 kJ/mol,则其燃烧反应的热化学方程式为:____________________。
(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应温度为460℃。低于460℃时,丙烯腈的产率________(填“是”或者“不是”)对应温度下的平衡产率,判断理由是_____________________;高于460℃时,丙烯腈产率降低的可能原因是________(双选,填标号)
A.催化剂活性降低 B.平衡常数变大 C.副反应增多 D.反应活化能增大
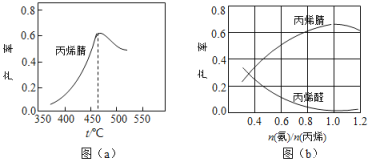
(3)丙烯腈和丙烯醛的产率与![]() 的关系如图(b)所示。由图可知最佳
的关系如图(b)所示。由图可知最佳![]() 约为________,理由是___________________。进料气氨、空气、丙烯的理论体积比约为________。
约为________,理由是___________________。进料气氨、空气、丙烯的理论体积比约为________。
(4)现以丙烯为原料,合成环状酯J。有关工艺流程图如下。已知:烯烃复分解反应是指在催化剂作用下,实现碳—碳双键两边基团换位的反应。如两个丙烯分子进行烯烃换位,生成丁烯和乙烯。
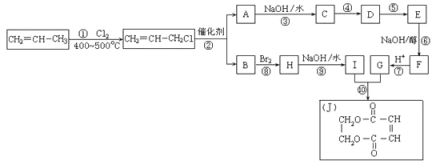
参考化学方程式:2CH2=CHCH3![]() CH3CH=CHCH3+CH2=CH2
CH3CH=CHCH3+CH2=CH2
i.①的反应类型是_____________,物质E的结构简式是___________。
ii.有机化合物C有多种同分异构体,请写出其中属于酯类且能发生银镜反应的所有同分异构体的结构简式__________________。
【答案】CH2=CH-CH3(g)+![]() O2(g)=3CO2(g)+3H2O(l) △H=-2049 kJ/mol 不是 该反应为放热反应,平衡产率应随温度升高而降低 AC 1 该比例下丙烯腈产率最高,而副产物丙烯醛产率最低 2:15:2 取代反应
O2(g)=3CO2(g)+3H2O(l) △H=-2049 kJ/mol 不是 该反应为放热反应,平衡产率应随温度升高而降低 AC 1 该比例下丙烯腈产率最高,而副产物丙烯醛产率最低 2:15:2 取代反应 ![]() HCOOCH2CH2CH3, HCOOCH(CH3)2
HCOOCH2CH2CH3, HCOOCH(CH3)2
【解析】
(1)根据燃烧热的定义书写热化学方程式。
(2)根据图像分析该反应为放热反应,根据温度对进行平衡移动的影响分析判断。产率降低主要从产率的影响因素进行考虑;
(3)根据图象可知,当![]() 约为1时,该比例下丙烯腈产率最高,而副产物丙烯醛产率最低,根据化学反应CH2=CH-CH3 (g)+NH3(g)+
约为1时,该比例下丙烯腈产率最高,而副产物丙烯醛产率最低,根据化学反应CH2=CH-CH3 (g)+NH3(g)+![]() O2(g)=CH2=CHCN(g)+3H2O(g),氨气、氧气、丙烯按1:1.5:1的体积比加入反应达到最佳状态,依据氧气在空气中约占20%计算条件比。
O2(g)=CH2=CHCN(g)+3H2O(g),氨气、氧气、丙烯按1:1.5:1的体积比加入反应达到最佳状态,依据氧气在空气中约占20%计算条件比。
(4)丙烯与氯气在加热条件下发生取代反应生成CH2=CHCH2Cl,由反应信息可知,CH2=CHCH2Cl在催化剂条件下发生复分解反应生成CH2=CH2、ClCH2CH=CHCH2Cl,A在氢氧化钠水溶液、加热条件下发生反应生成C,则A为ClCH2CH=CHCH2Cl,B为CH2=CH2;B与溴发生加成反应生成H为BrCH2CH2Br,H在氢氧化钠水溶液、加热条件下发生取代反应生成I为HOCH2-CH2OH;A在氢氧化钠水溶液、加热条件下发生反应生成C为HOCH2CH=CHCH2OH,由J的结构可知,G为HOOC-CH=CH-COOH,由转化关系可知,反应④是C与HCl加成生成D,保护碳碳双键不被氧化,D再氧化可得E,故D为HOCH2CH2CHClCH2OH,E为HOOCCH2CHClCOOH,E发生消去反应生成F,F酸化得到G,故F为NaOOC-CH=CH-COONa,据此解答。
(1)燃烧热是101kPa,1mol可燃物完全燃烧产生稳定的氧化物时放出的热量。丙烯的燃烧热为2049 kJ/mol,则其燃烧反应的热化学方程式为:CH2=CH-CH3(g)+![]() O2(g)=3CO2(g)+3H2O(l) △H=-2049 kJ/mol;
O2(g)=3CO2(g)+3H2O(l) △H=-2049 kJ/mol;
(2)根据图像丙烯腈的产率随温度升高先增大后减小,则该反应为放热反应,即低于460℃时,对应温度下的平衡转化率曲线应该是下降的,但实际曲线是上升的,这是由于温度升高,反应速率加快,更多的反应物转化为生成物,使物质产率增大,因此判断低于460℃时,丙烯腈的产率不是对应温度下的平衡转化率。当温度在460°C时,反应达到平衡状态,此后温度升高,化学平衡逆向移动,使丙烯腈产率降低。
A.催化剂在一定温度范围内活性较高,若温度过高,活性降低,反应速率减慢,A正确;
B.由于该反应的正反应是放热反应,升高温度,平衡向吸热的逆反应方向移动,所以由图象可知,升高温度平衡常数变小,故B错误;
C.根据题意,副产物有丙烯醛,副反应增多,导致产率下降,C正确;
D.反应活化能的大小与化学平衡无关,不影响化学平衡,D错误;
故合理选项是AC;
(3)根据图象可知,当![]() 约为1时,该比例下丙烯腈产率最高,而副产物丙烯醛产率最低,根据化学反应CH2=CH-CH3 (g)+NH3(g)+
约为1时,该比例下丙烯腈产率最高,而副产物丙烯醛产率最低,根据化学反应CH2=CH-CH3 (g)+NH3(g)+![]() O2(g)=C3H3N(g)+3H2O(g),氨气、氧气、丙烯按1:1.5:1的体积比加入反应达到最佳状态,由于氧气在空气中约占20%,所以进料氨、空气、丙烯的理论体积约为1:7.5:1=2:15:2;
O2(g)=C3H3N(g)+3H2O(g),氨气、氧气、丙烯按1:1.5:1的体积比加入反应达到最佳状态,由于氧气在空气中约占20%,所以进料氨、空气、丙烯的理论体积约为1:7.5:1=2:15:2;
(4) i.①的反应是CH2=CH-CH3与Cl2发生取代反应生成CH2=CH-CH2Cl,故反应类型是取代反应;根据上述推断可知物质E结构简式是HOOCCH2CHClCOOH;
ii.有机化合物C结构简式是HOCH2CH=CHCH2OH,该物质有多种同分异构体,其中属于酯类且能发生银镜反应,说明含有酯基,同时含有醛基,是甲酸酯,其同分异构体的结构简式为HCOOCH2CH2CH3, HCOOCH(CH3)。


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
【题目】常温下,在溶液中可发生以下反应:①16H++10Z-+2![]() ===2X2++5Z2+8H2O,②2M2++R2===2M3++2R-,③2R-+Z2===R2+2Z-,由此判断下列说法错误的是( )
===2X2++5Z2+8H2O,②2M2++R2===2M3++2R-,③2R-+Z2===R2+2Z-,由此判断下列说法错误的是( )
A.氧化性强弱顺序为:![]() <Z2<R2<M3+
<Z2<R2<M3+
B.还原性强弱顺序为:X2+<Z-<R-<M2+
C.Z元素在反应①中被氧化,在③中被还原
D.常温下可发生反应2M2++Z2===2M3++2Z-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用图中所示的装置进行实验,实验现象和预测不一致的是 ( )
| ①中的物质 | ②中的物质 | 预测现象 | |
A | 浓氨水 | FeCl3溶液 | ②中有红褐色沉淀 | |
B | 浓氨水 | 浓盐酸 | ③中有白烟 | |
C | 饱和氯水 | Na2S溶液 | ②中生成淡黄色沉淀 | |
D | 饱和亚硫酸 | 蓝色石蕊试液 | ②中溶液先变红后褪色 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应H2(g) + I2(g)![]() 2HI(g) + Q (Q > 0)在一带有活塞的密闭容器中达到平衡,下列说法错误的是 ( )
2HI(g) + Q (Q > 0)在一带有活塞的密闭容器中达到平衡,下列说法错误的是 ( )
A.恒容,升高温度,正反应速率减小B.恒容,充入H2(g),I2(g)的体积分数降低
C.恒压,充入He(g),逆反应速率减小D.恒温,压缩体积,平衡不移动,混合气体颜色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是由短周期元素中部分元素组成的一些单质及其化合物之间转化关系图。常温下,D、F、K均为无色无刺激性气味的气体,B是最常见的无色液体,A是由单质C在D中燃烧生成的淡黄色固体(反应中生成的部分物质已略去)。
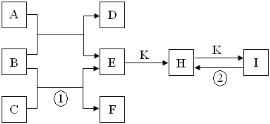
请回答下列问题:
(1)物质A的化学式为___,其阴、阳离子个数比为__。
(2)实验室将物质C通常保存在___中,请写出反应①的离子方程式___。
(3)反应②的化学方程式为___。
(4)有两个分别装有H和I固体的试剂瓶,因标签脱落而无法区分。若让你鉴别它们,下列试剂或方法中可选用的有___。
A.澄清石灰水 B.稀盐酸 C.加热,称重 D.焰色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应3A(g)![]() 3B(?)+C(?)△H>0,达到化学平衡后,进行下列操作。
3B(?)+C(?)△H>0,达到化学平衡后,进行下列操作。
(1)升高温度,用“变大”“变小”“不变”或“无法确定”填空。
①若B、C都是气体,气体的平均相对分子质量______;
②若B、C都不是气体,气体的平均相对分子质量______;
③若B是气体,C不是气体,气体的平均相对分子质量______;
(2)如果平衡后温度保持不变,将容器体积增大一倍,新平衡时A的浓度是原来的50%,判断B的状态是__________态,C的状态是__________态。
(3)某密闭容器中放入一定量的NO2,发生反应2NO2![]() N2O4(正反应放热),达平衡后,若分别单独改变下列条件,重新达到平衡后,能使混和气体平均分子量增大的是_________。
N2O4(正反应放热),达平衡后,若分别单独改变下列条件,重新达到平衡后,能使混和气体平均分子量增大的是_________。
A.通入N2 B.通入NO2 C.通入N2O4 D.升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锶有“金属味精”之称。以天青石(主要含有SrSO4和少量CaCO3、MgO杂质)生产氢氧化锶的工艺如下:
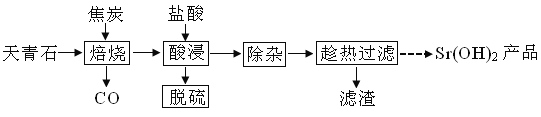
已知氢氧化锶在水中的溶解度:
温度(℃) | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
溶解度(g/100mL) | 0.91 | 1.25 | 1.77 | 2.64 | 3.95 | 8.42 | 20.2 | 44.5 | 91.2 |
(1)隔绝空气焙烧时SrSO4只被还原成SrS,化学方程式为____。
(2)“除杂”方法:将溶液升温至95℃,加NaOH溶液调节pH为12。
①95℃时水的离子积KW=1.0×10-12,Ksp[Mg(OH)2]=1.2×10-10,则溶液中c(Mg2+)=____。
②若pH过大,将导致氢氧化锶的产率降低,请解释原因____。
(3)“趁热过滤”的目的是____,“滤渣”的主要成分为___。
(4)从趁热过滤后的滤液中得到Sr(OH)2产品的步骤为____、过滤、洗涤、干燥。
(5)“脱硫”方法:用FeCl3溶液吸收酸浸产生的气体,吸收时的氧化产物为___(填化学式);再用石墨电极电解吸收液,电解后可在“脱硫”中循环利用的物质是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用下列装置进行乙醇催化氧化的实验。
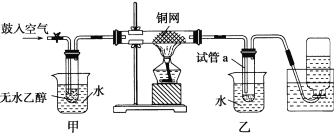
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学反应方程式:______。在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明乙醇的催化氧化反应是______反应。
(2)甲和乙两个水浴作用不相同,甲的作用是_________;乙的作用是:________。
(3)反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是____。集气瓶中收集到的气体的主要成分是______。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
化学键 | H—H | Cl—Cl | H—Cl |
生成1 mol化学键时放出的能量 | 436 kJ/mol | 243 kJ/mol | 431 kJ/mol |
则下列热化学方程式不正确的是 ( )
A.1/2H2(g)+1/2Cl2(g)===HCl(g)ΔH=-91.5 kJ/mol
B.H2(g)+Cl2(g)===2HCl(g) ΔH=-183 kJ/mol
C.2HCl(g)===H2(g)+Cl2(g) ΔH=+183 kJ/mol
D.1/2H2(g)+1/2Cl2(g)===HCl(g)ΔH=+91.5 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com