
【题目】常温下,在溶液中可发生以下反应:①16H++10Z-+2![]() ===2X2++5Z2+8H2O,②2M2++R2===2M3++2R-,③2R-+Z2===R2+2Z-,由此判断下列说法错误的是( )
===2X2++5Z2+8H2O,②2M2++R2===2M3++2R-,③2R-+Z2===R2+2Z-,由此判断下列说法错误的是( )
A.氧化性强弱顺序为:![]() <Z2<R2<M3+
<Z2<R2<M3+
B.还原性强弱顺序为:X2+<Z-<R-<M2+
C.Z元素在反应①中被氧化,在③中被还原
D.常温下可发生反应2M2++Z2===2M3++2Z-
【答案】A
【解析】
试题分析:氧化还原反应的方程的左边的氧化剂的氧化性大于右边的氧化剂,还原剂的还原性大于右边的还原剂,根据①16H++10Z-+2![]() ===2X2++5Z2+8H2O,②2M2++R2===2M3++2R-,③2R-+Z2===R2+2Z-,可以知道M3+<R2<Z2<
===2X2++5Z2+8H2O,②2M2++R2===2M3++2R-,③2R-+Z2===R2+2Z-,可以知道M3+<R2<Z2<![]() ,故A错误,为正确答案;还原性为X2+<Z-<R-<M2+,故B正确;根据①16H++10Z-+2
,故A错误,为正确答案;还原性为X2+<Z-<R-<M2+,故B正确;根据①16H++10Z-+2![]() ===2X2++5Z2+8H2O,可以知道,Z的化合价升高,所以被氧化,在③2R-+Z2===R2+2Z-,中,Z元素的化学价降低,被还原,故C正确,根据M3+<Z2,可以得到常温下可发生反应2M2++Z2===2M3++2Z-,所以D也正确,所以本题选A。
===2X2++5Z2+8H2O,可以知道,Z的化合价升高,所以被氧化,在③2R-+Z2===R2+2Z-,中,Z元素的化学价降低,被还原,故C正确,根据M3+<Z2,可以得到常温下可发生反应2M2++Z2===2M3++2Z-,所以D也正确,所以本题选A。


科目:高中化学 来源: 题型:
【题目】饮用水中的NO3对人类健康会产生危害,为了降低饮用水中NO3的浓度,可以在碱性条件下用铝粉将NO3还原为N2,其化学方程式为:
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。请回答下列问题:
(1)上述反应中,被氧化的元素_________,还原产物是________。
(2)用“双线桥法”表示反应中电子转移的方向和数目:_______________。
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O
(3)反应中每生成标况下22.4L N2,转移_______mol电子。
(4)请配平下列离子方程式。
____Fe2++____H+ +____NO3=____Fe3+ +____N2O↑+____H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是( )
A.16gO2和O3的混合气体中含有的分子数为0.5NA
B.0.3molAgNO3受热完全分解(2AgNO3=2Ag+2NO2↑+O2↑),用排水法收集到气体的分子数为 0.25NA
C.0.5NA个氯气分子所占体积约是11.2L
D.2.3g金属钠在装有氧气的集气瓶中完全燃烧,转移的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是“国际化学元素周期表年”。1869年门捷列夫把当时己知的元素根据物理、化学性质进行排列,准确预留了甲、乙两种未知元素的位置,并预测了二者的相对原子质量,部分原始记录如下。

下列说法不正确的是
A.元素甲比Al的最高价氧化物的水化物的碱性弱B.原子半径比较:甲>乙>Si
C.元素乙位于现行元素周期表第四周期第ⅣA族D.推测乙可以用作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某1L待测溶液中除含有0.2 mol·L-1的Na+外,还可能含有下列离子中的一种或多种:
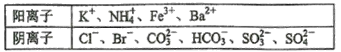
现进行如下实验操作(每次实验所加试剂均过量)
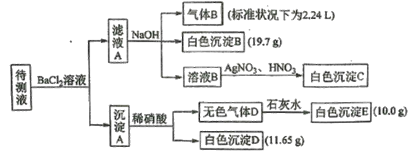
下列说法不正确的是
A.向溶液B中加AgNO3与HNO3的操作是多余的,待测液中一定含有的离子是K+、NH4+、CO32-、HCO3-、且c(K+)≥0.1mol·L-1
B.生成白色沉淀B的离子方程式为Ba2++HCO3-+OH-=BaCO3↓+H2O
C.已知白色沉淀C能溶于浓氨水,离子方程式为AgCl+2NH3·H2O=Ag(NH3)2++Cl-+2H2O
D.若无色气体D是混合气体,则沉淀A的成分可能是BaCO3、BaSO3、BaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】槟榔碱为油状液体,有拟胆碱作用,在医疗上用于治疗青光眼,能使绦虫瘫痪。某学生设计了以X为原料的合成路线如下:
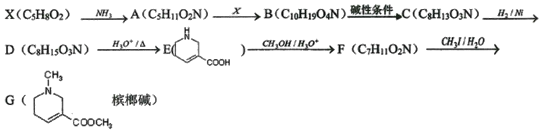
己知:①X能使溴水褪色、能水解,水解产物之一为乙醇。
②
③![]()
(1)槟榔碱中非氮官能团的名称__________,C的结构简式____________。
(2)下列说法正确的是_____________。
A.化合物A能形成内盐
B.化合物C的1H-NMR谱表明含6组峰
C.化合物D有碱性
D.化合物E能溶于水
E.化合物F在一定条件下能发生加聚、氧化、取代等反应
(3)D→E反应的方程式____________。
(4)烟酸![]() 也可以合成槟榔碱。写出烟酸的同分异构体,且符合下列条件的结构简式________。
也可以合成槟榔碱。写出烟酸的同分异构体,且符合下列条件的结构简式________。
①1H-NMR谱表明分子中有3种氢原子
②只含有一个六元环,环上无氧原子,且只有1个取代基
(5)结合题给信息,请设计由乙醇和E![]() 为原料合成化合物M
为原料合成化合物M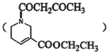 的路线,(用流程图表示,试剂任选)__________________________。
的路线,(用流程图表示,试剂任选)__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求完成下列各题:
(1)质量都是50 g的 HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是__________
(2)某溶液中只含有Na+、Al3+、Cl-、SO42-四种离子,已知前三种离子的个数比为1∶2∶1, 则溶液中Al3+和SO42-的离子个数比为__________。
(3)将一小块钠投入到盛CuSO4溶液的烧杯中,剧烈反应,放出气体并生成蓝色沉淀,其总反应的离子方程式为________________。
(4)将FeSO4溶液与过量NaOH溶液混合并在空气中放置一段时间,整个过程中的现象为______,反应过程分两步,其中第2步反应的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室中称取20gNaOH固体,配制500mL1mol·L-1的氢氧化钠溶液。
(1)该同学准备的实验用品有:托盘天平![]() 带砝码
带砝码![]() 、药匙、量筒、玻璃棒等,还缺少的玻璃仪器有__、__、___。
、药匙、量筒、玻璃棒等,还缺少的玻璃仪器有__、__、___。
(2)下列有关实验操作,正确的是__。(多选)
A.称量氢氧化钠固体时,应该放在称量纸上称量
B.某同学将称量的氢氧化钠固体溶解并冷却至室温,然后转移到容量瓶中
C.某同学在定容时,不小心加水超过刻度线,又将多余的液体吸出直至刻度线
D.某同学在溶解、转移完氢氧化钠溶液后,将溶解用的仪器洗涤2~3次,并将洗涤液转移到容量瓶中
(3)玻璃棒在该实验中的作用有①__,②___。
(4)若实验室遇到下列情况,对氢氧化钠溶液的物质的量浓度有何影响![]() 填“偏高”、“偏低”或“无影响”
填“偏高”、“偏低”或“无影响”![]()
①转移时,有少量的溶液洒落出容量瓶__。
②定容时,容量瓶中事先有洁净的蒸馏水,所配溶液的浓度___。
③定容时俯视溶液的凹液面___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯腈(CH2=CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH2=CHCHO)和乙腈(CH3CN)等,回答下列问题:
(1)用于生产丙烯腈的原料丙烯具有一定的危险性。某市化工园区曾发生一起丙烯储罐突然爆炸起火事件,大火产生的高温使消防队员难以靠近火场。已知丙烯的燃烧热为2049 kJ/mol,则其燃烧反应的热化学方程式为:____________________。
(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应温度为460℃。低于460℃时,丙烯腈的产率________(填“是”或者“不是”)对应温度下的平衡产率,判断理由是_____________________;高于460℃时,丙烯腈产率降低的可能原因是________(双选,填标号)
A.催化剂活性降低 B.平衡常数变大 C.副反应增多 D.反应活化能增大
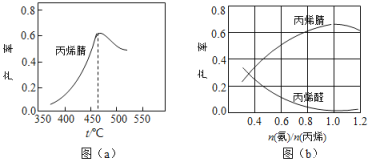
(3)丙烯腈和丙烯醛的产率与![]() 的关系如图(b)所示。由图可知最佳
的关系如图(b)所示。由图可知最佳![]() 约为________,理由是___________________。进料气氨、空气、丙烯的理论体积比约为________。
约为________,理由是___________________。进料气氨、空气、丙烯的理论体积比约为________。
(4)现以丙烯为原料,合成环状酯J。有关工艺流程图如下。已知:烯烃复分解反应是指在催化剂作用下,实现碳—碳双键两边基团换位的反应。如两个丙烯分子进行烯烃换位,生成丁烯和乙烯。
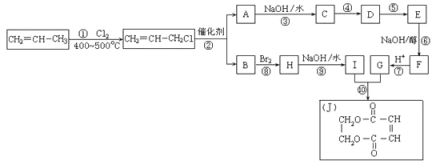
参考化学方程式:2CH2=CHCH3![]() CH3CH=CHCH3+CH2=CH2
CH3CH=CHCH3+CH2=CH2
i.①的反应类型是_____________,物质E的结构简式是___________。
ii.有机化合物C有多种同分异构体,请写出其中属于酯类且能发生银镜反应的所有同分异构体的结构简式__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com