
【题目】高纯硝酸锶[Sr(NO3)2]用于制造电视显像管、光学玻璃,也用于医药等。
I.工业硝酸锶中常含有硝酸钙、硝酸钡等杂质(硝酸钙可溶于浓硝酸,而硝酸锶、硝酸钡不溶于浓硝酸)。提纯硝酸锶的实验步骤如下:
①取含杂质的硝酸锶样品,__________,搅拌,过滤,并用浓HNO3洗涤滤渣。
②将滤渣溶于水中,加略过量(NH4)2Cr2O7(重铬酸铵),用氨水调节pH为7.5左右,使Ba2+沉淀,过滤。
③将滤液用硝酸调节pH为1时,慢慢加入H2C2O4·2H2O将过量的Cr2O72-还原为Cr3+,再用氨水调节pH=7,生成Cr(OH)3沉淀,过滤。
④将滤液用硝酸调节pH至2~3,蒸发浓缩,冷却结晶,过滤,洗涤。
⑤将得到的Sr(NO3)2·2H2O晶体在100 ℃条件下干燥,得到高纯硝酸锶。
(1)补充完整步骤①:
(2)步骤③中H2C2O4·2H2O将过量的Cr2O72-还原为Cr3+,同时产生一种无色无味的气体,写出该反应的离子方程式:__________。
(3)步骤③中生成的Cr(OH)3沉淀经处理后可以循环使用,方法是:一定条件下向Cr(OH)3中加入H2O2后,再加入氨水,即可得到(NH4)2Cr2O7(重铬酸铵)。请写出由Cr(OH)3生成(NH4)2Cr2O7的化学方程式:_____________。
(4)过氧化锶(SrO2·2H2O)制备原理:Sr(NO3)2+H2O2+2NH3·H2O=SrO2·2H2O↓+2NH4NO3。测得相同时间内 H2O2 的利用率随浓度的变化关系如图所示。5%的H2O2 比 20%的H2O2 的利用率低的原因是 _____________。

II.Sr(NO3)2受热易分解,生成Sr(NO2)2和O2;在500 ℃时,Sr(NO2)2进一步分解生成SrO及氮氧化物。取一定质量含Sr(NO2)2的Sr(NO3)2样品,加热至完全分解,得到10.40 g SrO固体和10.16 g混合气体。计算该样品中Sr(NO3)2的质量分数(请写出计算过程,结果精确到0.01)____________________。
【答案】向其中加入适量浓HNO3溶解 8H++3H2C2O4·2H2O+Cr2O72-=2Cr3++6CO2↑+13H2O(或8H++3H2C2O4+Cr2O72-=2Cr3++6CO2↑+7H2O) 2Cr(OH)3+3H2O2+2NH3·H2O=(NH4)2Cr2O7+7H2O 浓度低的双氧水反应速率慢,相同时间内反应的H2O2较少 m(样品)=10.40 g+10.16 g=20.56 g
n(SrO)=![]() =0.10 mol
=0.10 mol
n[Sr(NO3)2]×212 g/mol+n[Sr(NO2)2]×180 g/mol =20.56 g
n[Sr(NO3)2]+n[Sr(NO2)2]=0.10 mol
解得:n[Sr(NO3)2]=0.08 mol,n[Sr(NO2)2]=0.02 mol
w[Sr(NO3)2]=![]() ×100%=82.49%
×100%=82.49%
【解析】
I.(1)根据工业硝酸锶中含有硝酸钙、硝酸钡等杂质,硝酸钙可溶于浓硝酸,而硝酸锶、硝酸钡不溶于浓硝酸的性质向其中加入适量浓硝酸除去硝酸钙;
(2)根据氧化还原反应规律书写反应的离子方程式;
(3)Cr(OH)3被H2O2氧化为CrO42-,加入氨水,调节溶液的pH,Cr元素转化为Cr2O72-,根据电子守恒、原子守恒可得反应方程式;
(4)H2O2能够将Sr(NO3)2氧化为SrO2,根据图示可知5%的H2O2 比 20%的H2O2 的利用率低可从浓度对化学反应速率的影响分析;
II.先根据反应前后质量守恒计算出样品总质量,根据Sr元素守恒,计算出SrO的物质的量,然后根据Sr元素由Sr(NO3)2、Sr(NO2)2产生,再根据二者的质量关系计算得到Sr(NO3)2、Sr(NO2)2各自的物质的量和质量,进而得到Sr(NO3)2的质量分数。
(1)由于工业硝酸锶中含有硝酸钙、硝酸钡等杂质,由于杂质硝酸钙可溶于浓硝酸,而硝酸锶、硝酸钡不溶于浓硝酸,因此向其中加入适量浓硝酸充分振荡,可除去杂质硝酸钙;
(2)步骤③中H2C2O4·2H2O具有还原性,可将过量的Cr2O72-还原为Cr3+,H2C2O4·2H2O被氧化生成的一种无色无味的气体是CO2,根据电子守恒、原子守恒、电荷守恒,可得该反应的离子方程式:8H++3H2C2O4·2H2O+Cr2O72-=2Cr3++6CO2↑+13H2O,也可写为:8H++3H2C2O4+Cr2O72-=2Cr3++6CO2↑+7H2O;
(3)步骤③中生成的Cr(OH)3沉淀可被H2O2氧化为+6价的Cr,加入氨水,调节溶液的pH,Cr元素转化为Cr2O72-,根据电子守恒、原子守恒可得反应方程式:2Cr(OH)3+3H2O2+2NH3·H2O=(NH4)2Cr2O7+7H2O;
(4)H2O2具有强的氧化性,能够将Sr(NO3)2氧化为SrO2,根据图示可知5%的H2O2 比 20%的H2O2 的利用率低是因为双氧水的浓度低,化学反应速率慢,使得相同时间内反应的H2O2较少;
(5)m(样品)=10.40 g+10.16 g=20.56 g,n(SrO)=![]() =0.10 mol,根据Sr元素守恒,结合样品成分可知:n[Sr(NO3)2]×212 g/mol+n[Sr(NO2)2]×180 g/mol =20.56 g ,
=0.10 mol,根据Sr元素守恒,结合样品成分可知:n[Sr(NO3)2]×212 g/mol+n[Sr(NO2)2]×180 g/mol =20.56 g ,
n[Sr(NO3)2]+n[Sr(NO2)2]=0.10 mol ,解得:n[Sr(NO3)2]=0.08 mol,n[Sr(NO2)2]=0.02 mol
所以该样品中Sr(NO3)2的质量分数为:w[Sr(NO3)2]=![]() ×100%=82.49%。
×100%=82.49%。


科目:高中化学 来源: 题型:
【题目】高纯度氧化铝有广泛的用途,某研究小组研究用以下流程制取高纯度氧化铝:
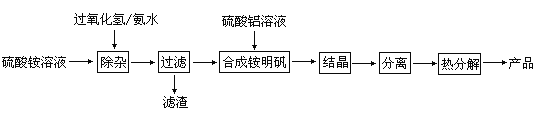
根据上述流程图填空:
(1)“除杂”操作是加入过氧化氢后,用氨水调节溶液的pH约为8.0,以除去硫酸铵溶液中的少量Fe2+。请写出在除去Fe2+离子的过程中,发生的主要反应的离子方程式____________________________。
(2)通常条件下Ksp〔Fe(OH)3〕=4.0×10—38,除杂后溶液中c(Fe3+)约为_____________。
(3)配制硫酸铝溶液时,需用硫酸酸化,酸化的目的是________________________。
(4)“结晶”这步操作中,母液经蒸发浓缩至溶液表面刚出现薄层晶体即停止加热,然后冷却结晶,得到铵明矾晶体(含结晶水)。母液不能蒸干的原因是____________。
(5)“分离”操作的名称是_____________(填字母代号)。
A.蒸馏 B.分液 C.过滤
(6)铵明矾晶体的化学式为NH4Al(SO4)2·12H2O,在0.1mol/L铵明矾的水溶液中,离子浓度最大的离子是__________,离子浓度最小的离子是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用18.4 mol/L的浓![]() 来配制500 mL 0.2 mol/L的稀
来配制500 mL 0.2 mol/L的稀![]() 。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥托盘天平 ⑦药匙。请回答下列问题:
。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥托盘天平 ⑦药匙。请回答下列问题:
(1)上述仪器中,在配制稀![]() 时不需要使用的有________________(填代号),还缺少的仪器是________________。
时不需要使用的有________________(填代号),还缺少的仪器是________________。
(2)经计算,需浓![]() 的体积为________,量取浓硫酸时应选用________(选填①10 mL、②50 mL、③100 mL三种规格)的量筒。
的体积为________,量取浓硫酸时应选用________(选填①10 mL、②50 mL、③100 mL三种规格)的量筒。
(3)配制一定物质的量浓度NaOH溶液的实验中,如果出现以下操作:
A.称量用了生锈的砝码; B.将NaOH放在纸张上称量;
C.定容时仰视刻度线 D.往容量瓶转移时,有少量液体溅出
E.未洗涤溶解NaOH的烧杯 F.容量瓶未干燥即用来配制溶液
G.定容后塞上瓶塞反复摇匀,静置后液面不到刻度线,未加水至刻度线。
H.未冷却至室温就进行定容 I.定容时有少量水洒在容量瓶外
对配制的溶液物质的量浓度大小可能造成的影响是(填写字母)偏大的有_________;偏小的有__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置的说法中正确的是
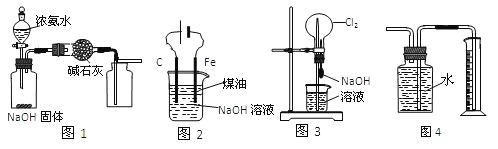
A. 用图1装置制取干燥纯净的NH3
B. 用图2装置制备Fe(OH)2并能较长时间观察其颜色
C. 用图3装置可以完成“喷泉”实验
D. 用图4装置测量Cu与浓硝酸反应产生气体的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一化工厂以废铁屑为原料制备FeCl3溶液,用作印刷电路铜板腐蚀剂,并对溶液B进行电解处理的实验流程如图:

(1)试剂a应选用________(填写名称);
(2)步骤Ⅰ用到的主要玻璃仪器有漏斗、________(填写仪器名称);
(3)写出步骤Ⅱ中主要反应的化学方程式____________________;
(4)实验室制取气体E的离子方程式是________________________,欲对气体E进行干燥和吸收,需选用下列装置中的________(填写序号);

(5)如何用化学方法检验气体E?______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表达式中正确的是( )
A. 向氯化钙溶液中通入CO2:CaCl2+CO2+H2O=CaCO3↓+2HCl
B. 铁跟盐酸反应:Fe+2HCl=FeCl2+H2↑
C. NaHCO3溶液的电离方程式:NaHCO3=Na++H+ +CO32-
D. 向沸水中滴加 FeCl3 溶液制备Fe(OH)3 胶体:FeCl3+3H2O=Fe(OH)3↓+3HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 常温下醋酸分子不可能存在于pH>7的碱性溶液中
B. 常温下pH=2的H2SO4与pH=13的NaOH溶液混和,所得混和液的pH=11,则H2SO4溶液与NaOH溶液的体积比是9:1
C. 0.1mol/L硫化钠溶液中,c(S2-)+c(HS-)+2c(H2S)=0.1mol/L
D. 常温下向氯化铵溶液中加入少量氨水使溶液的pH=7,则混合溶液中c(NH4+)>c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有七种元素,其中A,B,C,D,E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
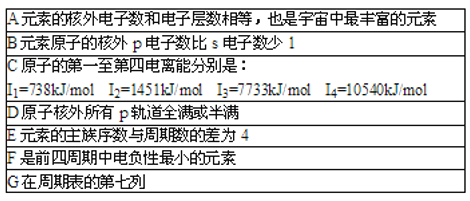
(1)已知BA5为离子化合物,写出其电子式__;
(2)B基态原子中能量最高的电子,其电子云在空间有_个方向,原子轨道呈_____形;
(3)某同学根据上述信息,推断C基态原子的核外电子排布为![]() 该同学所画的电子排布图违背了__;
该同学所画的电子排布图违背了__;
(4)G位于__族_区,价电子排布式为__;
(5)DE3中心原子的杂化方式为__,用价层电子对互斥理论推测其空间构型为__.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com