
【题目】高纯度氧化铝有广泛的用途,某研究小组研究用以下流程制取高纯度氧化铝:
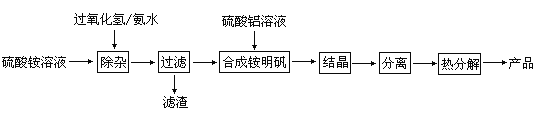
根据上述流程图填空:
(1)“除杂”操作是加入过氧化氢后,用氨水调节溶液的pH约为8.0,以除去硫酸铵溶液中的少量Fe2+。请写出在除去Fe2+离子的过程中,发生的主要反应的离子方程式____________________________。
(2)通常条件下Ksp〔Fe(OH)3〕=4.0×10—38,除杂后溶液中c(Fe3+)约为_____________。
(3)配制硫酸铝溶液时,需用硫酸酸化,酸化的目的是________________________。
(4)“结晶”这步操作中,母液经蒸发浓缩至溶液表面刚出现薄层晶体即停止加热,然后冷却结晶,得到铵明矾晶体(含结晶水)。母液不能蒸干的原因是____________。
(5)“分离”操作的名称是_____________(填字母代号)。
A.蒸馏 B.分液 C.过滤
(6)铵明矾晶体的化学式为NH4Al(SO4)2·12H2O,在0.1mol/L铵明矾的水溶液中,离子浓度最大的离子是__________,离子浓度最小的离子是____________。
【答案】2Fe2++H2O2+4NH3·H2O=2Fe(OH)3↓+4NH4+ 4×10—20mol/L 抑制(防止)Al3+水解 防止晶体失去结晶水,避免可溶性杂质结晶析出 C SO42- OH-
【解析】
(1)H2O2可以把Fe2+氧化为Fe3+,然后加入氨水,就会形成Fe(OH)3沉淀而过滤除去,反应的离子方程式是2Fe2++H2O2+4NH3·H2O=2Fe(OH)3↓+4NH4+;
(2)pH=8.0,则c(OH—)=10-6mol/L,在通常条件下Ksp〔Fe(OH)3〕=c(Fe3+)·c3(OH—)=4.0×10—38,所以c(Fe3+)= Ksp〔Fe(OH)3〕÷c3(OH—)= 4.0×10—38÷10-18=4×10—20mol/L;
(3)硫酸铝是强酸弱碱盐,水解产生氢氧化铝胶体和硫酸,加入硫酸就可以抑制盐电离产生的Al3+的水解;
(4)“结晶”这步操作中,母液经蒸发浓缩至溶液表面刚出现薄层晶体即停止加热,然后冷却结晶,得到铵明矾晶体(含结晶水)。母液不能蒸干是因为蒸干容易使晶体失去结晶水,这样还避免可溶性杂质结晶析出;
(5)把晶体从混合物中“分离”操作的名称是过滤;
(6)铵明矾晶体的化学式为NH4Al(SO4)2·12H2O,在0.1mol/L在铵明矾的水溶液中,根据物料守恒可知离子浓度最大的离子是SO42—,由于该盐是强酸弱碱盐,NH4+、Al3+水解消耗水电离产生的OH-,使溶液显酸性,所以离子浓度最小的离子是OH—。


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
【题目】CO2+Ca(OH)2=CaCO3↓+H2O,CaCO3+CO2+H2O=Ca(HCO3)2,且Ca(HCO3)2易溶于水。现有Ca(OH)2溶液,向其溶液中逐渐通入CO2。则下列四个图中,能比较准确地反映出溶液的导电能力和通入CO2气体量的关系的是(x轴表示CO2通入的量,y轴表示导电能力)
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是实验室制取少量固体氧化铜的实验,根据实验步骤,回答有关问题。

(1)调整天平零点时,若指针偏向右边,应将左边的螺丝____________(填“向左”或“向右”)旋动。
(2)滴加NaOH溶液,生成沉淀的离子方程式为_______________________________。
(3)加热蒸发过程中要用到玻璃棒,其作用是_________________________________。
(4)洗涤该沉淀的方法是______________________________________________________,为了检验此沉淀是否洗涤干净,应取最后一次的洗涤液少许,加入__________溶液检验。
(5)若向CuSO4溶液中滴加了100mLNaOH溶液,则NaOH溶液的物质的量浓度至少为_________。
(6)理论上最多可以制得CuO的质量为 _______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 已知常温下部分弱电解质的电离平衡常数如下表:
化学式 | HF | HClO | H2CO3 | NH3·H2O |
电离常数 | 6.8×104 | 4.7×108 | K1=4.3×107 K2=5.6×1011 | Kb=1.7×105 |
(1)常温下,PH相同的三种溶液①NaF溶液 ②NaClO溶液 ③Na2CO3溶液,其物质的量溶度由大到小的顺序是___________(填序号)
(2)25°C时,PH=4的NH4Cl溶液中各离子浓度的大小关系为___________________
(3)0.1 mol/L的NaClO溶液和0.1 mol/L的NaHCO3溶液中,c(ClO-)________ c(HCO3-)(填“>,<,=”)可使上述两种溶液PH相等的方法是___________(填代号)
a.向NaClO溶液中加适量的水 b.向NaClO溶液中加适量的NaOH
c.向NaHCO3溶液中加适量的水 d. 向NaHCO3溶液中加适量的NaOH
(4)向NaClO溶液中通入少量的CO2,所发生的离子方程式为_________
(5)常温下,0.1mol/L的氨水和0.1mol/L的NH4Cl溶液等体积混合,判断混合溶液的酸碱性____________(填“酸性”“碱性”“中性”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体的结构示意图,请回答下列问题:


图Ⅲ 铜晶体中铜原子堆积模型
(1)图Ⅰ所示的CaF2晶体中与Ca2+最近且等距离的F-数为________________,图Ⅲ中未标号的铜原子形成晶体后周围最紧邻的铜原子数为__________________________________。
(2)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是________,H3BO3晶体中B原子个数与极性键个数比为____________。
(3)金属铜具有很好的延展性、导电性、传热性,对此现象最简单的解释是用________理论。
(4)三种晶体中熔点最低的是________(填化学式),其晶体受热熔化时,克服的微粒之间的相互作用为____________________________________________________________。
(5)已知两个距离最近的Ca2+核间距离为a×10-8cm,结合CaF2晶体的晶胞示意图,CaF2晶体的密度为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分物质和反应条件已略去)。A是生产生活中使用最广泛的金属单质,B是一种无色无味的液体,D是一种磁性氧化物,灼烧G的火焰呈黄色,F是一种黄绿色气体,K中一种元素的化合价为+5。
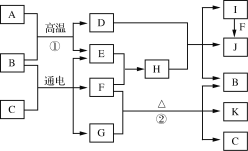
(1) I的化学式为______。
(2) G的电子式为 ______。
(3) 写出反应①的化学方程式:________________。
(4) 写出反应②的离子方程式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Mg2+、NH4+、Al3+混合溶液中加入Na2O2的量与生成沉淀和气体的量(纵坐标)的关系如图所示,则溶液中Mg2+、NH4+、Al3+三种离子的物质的量之比为( )
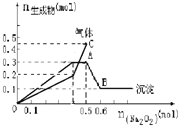
A. 1∶1∶2B. 2∶2∶1
C. 1∶2∶2D. 9∶2∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硝酸锶[Sr(NO3)2]用于制造电视显像管、光学玻璃,也用于医药等。
I.工业硝酸锶中常含有硝酸钙、硝酸钡等杂质(硝酸钙可溶于浓硝酸,而硝酸锶、硝酸钡不溶于浓硝酸)。提纯硝酸锶的实验步骤如下:
①取含杂质的硝酸锶样品,__________,搅拌,过滤,并用浓HNO3洗涤滤渣。
②将滤渣溶于水中,加略过量(NH4)2Cr2O7(重铬酸铵),用氨水调节pH为7.5左右,使Ba2+沉淀,过滤。
③将滤液用硝酸调节pH为1时,慢慢加入H2C2O4·2H2O将过量的Cr2O72-还原为Cr3+,再用氨水调节pH=7,生成Cr(OH)3沉淀,过滤。
④将滤液用硝酸调节pH至2~3,蒸发浓缩,冷却结晶,过滤,洗涤。
⑤将得到的Sr(NO3)2·2H2O晶体在100 ℃条件下干燥,得到高纯硝酸锶。
(1)补充完整步骤①:
(2)步骤③中H2C2O4·2H2O将过量的Cr2O72-还原为Cr3+,同时产生一种无色无味的气体,写出该反应的离子方程式:__________。
(3)步骤③中生成的Cr(OH)3沉淀经处理后可以循环使用,方法是:一定条件下向Cr(OH)3中加入H2O2后,再加入氨水,即可得到(NH4)2Cr2O7(重铬酸铵)。请写出由Cr(OH)3生成(NH4)2Cr2O7的化学方程式:_____________。
(4)过氧化锶(SrO2·2H2O)制备原理:Sr(NO3)2+H2O2+2NH3·H2O=SrO2·2H2O↓+2NH4NO3。测得相同时间内 H2O2 的利用率随浓度的变化关系如图所示。5%的H2O2 比 20%的H2O2 的利用率低的原因是 _____________。

II.Sr(NO3)2受热易分解,生成Sr(NO2)2和O2;在500 ℃时,Sr(NO2)2进一步分解生成SrO及氮氧化物。取一定质量含Sr(NO2)2的Sr(NO3)2样品,加热至完全分解,得到10.40 g SrO固体和10.16 g混合气体。计算该样品中Sr(NO3)2的质量分数(请写出计算过程,结果精确到0.01)____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com