
【题目】在化学反应2KI+Cl2=2KCl+I2中,作还原剂的是
A. KI B. Cl2 C. KCl D. I2
科目:高中化学 来源: 题型:
【题目】下列关于物质分类的正确组合是( )
类别 组合 | 酸性氧化物 | 碱性氧化物 | 酸 | 碱 | 盐 |
A | CO2 | SiO2 | H2SO4 | Na2CO3 | NaHCO3 |
B | CO | Na2O | HCl | NaOH | NaCl |
C | SO2 | CuO | CH3COOH | KOH | CaF2 |
D | SO3 | CaO | HNO3 | Ca(OH)2 | CaCO3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机化合物的结构式和立体模型如下:

解决有机分子结构问题的最强有力手段是核磁共振。下图是计算机软件模拟出的该物质的1H核磁共振谱图(单位是ppm):

试回答下列问题:
(1)与立体模型相比,结构式中的Et表示__________(填名称),该有机物的分子式为______________。
(2)该分子中共有__________种化学环境不同的氢原子,化学环境相同的氢原子最多有________个,最少有________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式及其叙述正确的是( )
A. 氢气的燃烧热为285.5kJ/mo1,则水电解的热化学方程式为:2H2O(l)═2H2(g)+O2(g);△H=+285.5kJ/mol
B. 1mol甲烷完全燃烧生成CO2和H2O(l)时放出890kJ热量,它的热化学方程式为
![]() CH4(g)+O2(g)═
CH4(g)+O2(g)═![]() CO2(g)+H2O(l);△H=-445kJ/mol
CO2(g)+H2O(l);△H=-445kJ/mol
C. 已知2C(s)+O2(g)═2CO(g);△H=-221kJ/mol,则C的燃烧热为110.5kJ/mol
D. 已知中和热为57.3kJ/mol,HF与NaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2![]() 2NO+O2在恒容密闭容器中反应,不能判断此反应达到最大限度的标志是( )
2NO+O2在恒容密闭容器中反应,不能判断此反应达到最大限度的标志是( )
A. 单位时间内生成n mol O2 的同时,生成2n molNO2 B. 混合气体的平均相对分子质量不再改变
C. 混合气体的颜色不再改变 D. NO2, NO, O2的速率之比是2:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2分解速率受多种因素影响。实验测得 70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是 ( )

A. 图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B. 图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C. 图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
D. 图丙表明,少量Mn 2+存在时,溶液碱性越强,H2O2分解速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见的太阳能电池有单晶硅太阳能电池、多晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒等多种元素构成薄膜太阳能电池。回答下列问题:
(1)基态亚铜离子(Cu+)的价层电子排布式为__________。
(2)砷、硒是第四周期的相邻元素,已知砷的第一电离能(947kJ·mo1-1)大于硒(941k]·mol-l)。请从原子结构的角度加以解释__________。
(3)H2O的沸点高于H2Se的沸点,其原因是__________。
(4)GaCl3和AsF3的分子立体构型分别是__________,__________。
(5)硼酸(H3BO3)本身不能电离出H+,在水中易结合一个OH-生成[B(OH)4]-,而体现弱酸性。
①[B(OH)4] -中B原子的杂化类型为__________。
②[B(OH)4] -的结构式为__________。
(6)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。

①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是__________(用化学式表示)
②金刚石的晶胞参数为apm(lpm=10-12m),1cm3晶体的平均质量为__________g(只要求列算式,阿伏加德罗常数的值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备氯化氢的反应化学方程式为:H2SO4(浓)+NaCl=HCl↑+NaHSO4,回答以下问题:
(1)该反应能发生的原因是________________。
A.硫酸酸性强于盐酸 B.盐酸易挥发 C.硫酸氧化性强于盐酸
(2)向NaHSO4溶液中滴加Ba(OH)2溶液至中性,反应的离子方程式为_____________________。
(3)实验室需要配制0.50 mol·L-1 NaCl溶液240 mL。
①所需的仪器有:托盘天平、药匙、烧杯、________、______、______以及等质量的两片滤纸。
②配制该溶液需取NaCl晶体______ g。
③配制一定物质的量浓度溶液定容时的操作是____________________________________
(4)在标准状况下,将44.8 L HCl气体溶于127 mL水中,所得盐酸的密度为1.18 g·cm-3。该盐酸的物质的量浓度是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列问题:
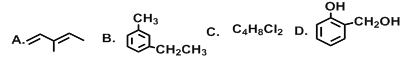

(1)G在同一直线上的碳原子数为___________;
(2)上述有机物互为同分异构体的是__________(填字母);
(3)A的系统命名为______________,它与Cl2以1:1比例反应时产物有_________种;
(4)上述有机物能与金属钠反应的是_________(填字母),能与碳酸氢钠反应的是______(填字母),B与酸性高锰酸钾反应的产物是______________(填结构简式);
(5)C的同分异构体有________种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com