
【题目】按要求完成下列问题:
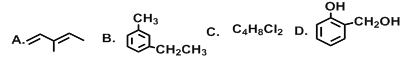

(1)G在同一直线上的碳原子数为___________;
(2)上述有机物互为同分异构体的是__________(填字母);
(3)A的系统命名为______________,它与Cl2以1:1比例反应时产物有_________种;
(4)上述有机物能与金属钠反应的是_________(填字母),能与碳酸氢钠反应的是______(填字母),B与酸性高锰酸钾反应的产物是______________(填结构简式);
(5)C的同分异构体有________种。
【答案】4EF3-甲基-1,3-戊二烯3DEE![]() 9
9
【解析】
(1)由乙炔分子的空间构型可知G分子中有四个碳原子在同一条直线上,故答案为:4;
(2)上述有机物中E和F的结构不同,分子式均为:C7H6O2,故答案为:EF;
(3)A分子中含有两个双键,其系统名称为:3-甲基-1,3-戊二烯,故答案为:3-甲基-1,3-戊二烯;
(4)D分子中含有羟基,E分子中含有羧基,能与金属钠反应;E分子中含有有羧基,能与碳酸氢钠反应;B为苯的同系物,被氧化生成![]() ;故答案为: DE、 E、
;故答案为: DE、 E、![]() ;
;
(5)C的分子结构中含有两个碳原子,碳链有两种连接方式,丁基有四种结构,其一代物有四种,然后再移动另一个氯原子的位置,共有9种不同的结构,故答案为:9。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】钛酸钡(BaTiO3)在工业上有重要用途,主要用于制作电子陶瓷、PTC热敏电阻、电容器等多种电子元件。以下是生产钛酸钡的一种工艺流程图:
![]()
已知:①草酸氧化钛钡晶体的化学式为BaTiO(C2O4)2·4H2O;
②25℃时,BaCO3的溶度积Ksp=2.58×10-9;
(1)BaTiO3中Ti元素的化合价为:__________。
(2)用盐酸酸浸时发生反应的离子方程式为: __________。
(3)流程中通过过滤得到草酸氧化钛钡晶体后,为提高产品质量需对晶体洗涤。
①过滤操作中使用的玻璃仪器有_____________________。
②如何证明晶体已洗净?_______________________。
(4)TiO2具有很好的散射性,是一种有重要用途的金属氧化物。工业上可用TiCl4水解来制备,制备时需加入大量的水,同时加热,其目的是:_______________。
(5)某兴趣小组取19.70gBaCO3模拟上述工艺流程制备BaTiO3,得产品13.98g,BaTiO3的产率为:________。
(6)流程中用盐酸酸浸,其实质是BaCO3溶解平衡的移动。若浸出液中c(Ba2+)=0.1mol/L,则c(CO32-)在浸出液中的最大浓度为__________ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A. 不粘锅表面涂有的聚四氟乙烯不能使溴的四氯化碳溶液褪色
B. 工业酒精因含有甲醇,饮后可能会造成人的双目失明甚至死亡
C. 化合物![]() 属于烃的衍生物,能发生加聚反应
属于烃的衍生物,能发生加聚反应
D. 苯酚有杀菌和止痛作用,可以直接涂抹到皮肤上消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应方程式正确的是( )
A. 苯酚与纯碱溶液混合反应的离子方程式:2C6H5OH + CO32-→CO2↑+ H2O + 2C6H5O-
B. 溴乙烷与氢氧化钠水溶液反应:![]()
C. 醋酸除水垢的离子方程式:CaCO3 + 2H+= Ca2+ + CO2↑+H2O
D. 苯甲醇与氧气发生催化氧化:2C6H5CH2OH + O2![]() 2C6H5CHO + 2H2O
2C6H5CHO + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年度国家科学技术奖授予我国诺贝尔奖获得者屠呦呦,表彰她在抗疟疾青蒿素方面的研究。
(查阅资料)青蒿素熔点156~157℃,易溶于丙酮、氯仿和乙醚,在水几乎不溶。
I.实验室用乙醚提取青蒿素的工艺流程如下:

(1)在操作I前要对青蒿进行粉碎,其目的是________________
(2)操作II的名称是_____________。
(3)操作III进行的是重结晶,其操作步骤为_____ 、_____、______、过滤、洗涤、干燥
II.已知青蒿素是一种烃的含氧衍生物为确定它的化学式,进行了如下实验:

实验步骤:①连接装置,检查装置的气密性。②称量E、F中仪器及药品的质量。③取14.10g青蒿素放入硬质试管C中,点燃C、D处酒精灯加热,充分燃烧④实验结束后冷却至室温,称量反应后E、F中仪器及药品的质量。
(4)装置E、F应分别装入的药品为_______________、___________________。
(5)实验测得:
装置 | 实验前 | 实验后 |
E | 24.00g | 33.90g |
F | 100.00g | 133.00g |
通过质谱法测得青蒿素的相对分子质量为282,结合上述数据,得出青蒿素的分子式为______。
(6)若使用上述方法会产生较大实验误差,你的改进方法是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钠用作甲状腺肿瘤防治剂、祛痰剂和利尿剂等。实验室用NaOH、单质碘和水合肼(N2H4·H2O)为原料可制备碘化钠。
资料显示:水合肼有还原性,能消除水中溶解的氧气;NaIO3是一种氧化剂。
回答下列问题:
(1)水合肼的制备:有关反应原理为:NaClO + 2NH3 = N2H4·H2O + NaCl。
①用下图装置制取水合肼,其连接顺序为_________(按气流方向,用小写字母表示)。




②装置A的作用是_______。
③开始实验时,先向氧化钙中滴加浓氨水,一段时间后再向B的三口烧瓶中滴加NaClO溶液。滴加NaClO溶液时不能过快的理由___________。
(2)碘化钠的制备
ⅰ.向三口烧瓶中加入8.4gNaOH及30mL水,搅拌、冷却,加入25.4g碘单质,开动磁力搅拌器,保持60~70℃至反应充分;
ⅱ.继续加入稍过量的N2H4·H2O(水合肼),还原NaIO和NaIO3,得NaI溶液粗品,同时释放一种空气中的气体;
ⅲ.向上述反应液中加入1.0g活性炭,煮沸半小时,然后将溶液与活性炭分离;
ⅳ.将步骤ⅲ分离出的溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得产品24.0g。
④步骤ⅰ适宜采用的加热方法是水浴加热, 该步骤反应完全的现象是_________。步骤ⅱ中IO3-参与反应的离子方程式为________________________________。
⑤步骤ⅲ “将溶液与活性炭分离”的方法是趁热过滤。
⑥本次实验产率为__________。实验发现,水合肼实际用量比理论值偏高,可能的原因是___________。
⑦某同学检验产品NaI中是否混有NaIO3杂质。取少量固体样品于试管中,加水溶解,滴加少量淀粉液后再滴加适量稀硫酸,片刻后溶液变蓝。得出NaI中含有NaIO3杂质。请评价该实验结论的合理性____________。(若认为合理写出离子方程式,若认为不合理说明理由)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢(H2O2)溶液俗称双氧水,医疗上常用3%的双氧水进行伤口消毒。H2O2能与SO2反应生成H2SO4, H2O2的分子结构如图所示。下列说法错误的是( )

A. H2O2的结构式为H—O—O—H
B. H2O2为含有极性键和非极性键的共价化合物
C. 与SO2在水溶液中反应的离子方程式为SO2+ H2O2=2H++SO42-
D. H2O2与SO2反应过程中有共价键断裂,同时有共价键和离子键形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于非氧化还原反应的是
A. 2H2O2![]() 2H2O +O2↑B. Cl2+H2O
2H2O +O2↑B. Cl2+H2O![]() HCl+HClO
HCl+HClO
C. SO2 + 2NaOH=Na2SO3 + H2OD. C+4HNO3(浓) ![]() CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com