
【题目】某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。进行如下实验:
![]()
A. 步骤Ⅰ中减少的3 g固体一定是混合物
B. 步骤Ⅱ中质量减少的物质一定是Cu
C. 根据步骤Ⅰ、Ⅱ可以判断混合物X的成分为Al2O3、Fe2O3、Cu、SiO2
D. 根据上述步骤Ⅱ可以得出m(Fe2O3)∶m(Cu)=1∶1
【答案】D
【解析】
A.步骤Ⅰ中,加入过量氢氧化钠溶液固体质量减少了3 g,溶解的物质可能是Al2O3和SiO2中的一种或两种,不一是混合物,故A错误;
B.步骤Ⅱ中加入过量盐酸反应后得到蓝色溶液和不溶的固体,说明Fe2O3溶解后生成铁离子,铁离子又和Cu发生反应生成铜离子,故减少的固体是Fe2O3和Cu,故B错误;
C. 根据步骤Ⅰ、Ⅱ可以判断混合物X的成分中一定含有Fe2O3和Cu,可能含有SiO2 与Al2O3中的一种或两种,故C错误;
D.步骤Ⅱ中发生的总反应为Fe2O3+Cu+6HCl===2FeCl2+CuCl2+3H2O,不溶的固体是铜,溶解的固体(6.4-1.92=4.48 g)中,Fe2O3和Cu的物质的量相等,设其物质的量为xmol,则有160x+64x=4.48,解得x=0.02,其中m(Fe2O3)=0.02mol×160g/mol=3.2g,m(Cu)=0.02mol×64g/mol+1.92g=3.2g,即有m(Fe2O3)∶m(Cu)=1∶1,故D正确;
答案选D。


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
【题目】实验室可用如图装置(启普发生器)制取氢气,欲使得到氢气的速率加快,下列措施可行的是
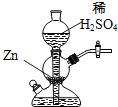
A. 将稀硫酸改为浓硫酸
B. 向稀硫酸中加入少量![]() 固体
固体
C. 向稀硫酸中加入![]() 溶液
溶液
D. 给装置中发生反应的部分加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A. CH2=CHCOOH、CH3COOCH=CH2均可作为合成聚合物的单体
B. C6Hn分子中的六个碳原子在同一直线上,则n可能等于2
C. 2,2-二甲基丁烷与2,4-二甲基戊烷的一氯代物种类相同
D.  与
与 都是酚且互为同系物
都是酚且互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有 关汉黄芩素的叙述正确的是

A. 汉黄芩素的分子式为 C16H13O5
B. 该物质遇 FeCl3 溶液显色
C. 1 mol 该物质与溴水反应,最多消耗 1 mol Br2
D. 与足量 H2 发生加成反应后,该分子中官能团的种类减少 1 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中导电性最强的是
A. 1L0.1mol/L醋酸B. 0.1L 0.1mol/L H2SO4溶液
C. 0.5L 0.1mol/L盐酸D. 2L 0.1mol/L H2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国在CO2催化加氢制取汽油方面取得突破性进展,CO2转化过程示意图如图:
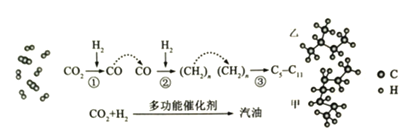
回答下列问题:
(1)二氧化碳分子中的化学键是______,物质乙的结构简式是______。
(2)写出反应![]() 的化学方程式______。
的化学方程式______。
(3)实验室常用纯净碳酸钙与稀盐酸反应制取二氧化碳气体,反应过程中产生二氧化碳的体积V(CO2)与时间关系如图:
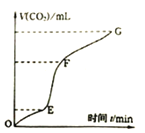
①由图象分析,化学反应速率最快一段是______。
②为了增大上述化学反应的反应速率,欲向溶液中加入下列物质或采取如下操作,你认为可行的是______![]() 填写序号
填写序号![]() 。
。
A.蒸馏水 B.氯化钠溶液 C.浓盐酸 D.加热
(4)二氧化碳能与氢氧化钠溶液反应,当二氧化碳与氢氧化钠反应的物质的量之比为2∶3时,溶液中的溶质是________。(填化学式)
(5)在一定条件下,工业上也可用CO2合成甲醇(CH3OH),其化学方程式为:CO2+3H2![]() CH3OH+H2O。将a molCO2与bmolH2充入容积为2L的密闭容器中发生上述反应,tmin时测得甲醇的物质的量为cmol。计算0-tmin内CO2的反应速率为______mol/(L·s)。[X的反应速率ν(X)=
CH3OH+H2O。将a molCO2与bmolH2充入容积为2L的密闭容器中发生上述反应,tmin时测得甲醇的物质的量为cmol。计算0-tmin内CO2的反应速率为______mol/(L·s)。[X的反应速率ν(X)=![]() ]
]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列下列关于F、Cl、Br、I的比较,不正确的是( )
A.单质的氧化性随核电荷数的增加而减弱
B.单质的颜色随核电荷数的增加而加深
C.它们的氢化物的稳定性随核电荷数的增加而增强
D.它们的原子核外电子层数随核电荷数的增加而增多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物![]() 在医药合成中有着广泛的用途。下列而关该物质的说法正确的是
在医药合成中有着广泛的用途。下列而关该物质的说法正确的是
A. 该化含物中含氧官能团为酯基
B. 该化台物中的所有碳原子一定处于同一平面内
C. 该化合物可发生取代反应、加成反应和氧化反应
D. 该化合物的同分异构体中,苯环上有两个取代基的共3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
X | L层p电子数比s电子数多2个 |
Y | 第三周期元素的简单离子中半径最小 |
Z | L层有三个未成对电子 |
(1)写出元素X的离子结构示意图____________。
(2)写出Y元素最高价氧化物的水化物与NaOH溶液反应的离子方程式______________
(3)写出Y的价电子排布式_________________________。
(4)元素T与氯元素相比,非金属性较强的是_______(用元素符号表示),下列表述中能用于证明这一事实的是_______(填字母代号)。
A.气态氢化物的挥发性 B.两元素的电负性
C.含氧酸的酸性 D.氢化物中X—H键的键长(X代表T和Cl两种元素)
(5)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是___(填元素符号)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com