
【题目】一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+ 2D(s)。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol/L。下列判断正确的是
xC(g)+ 2D(s)。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol/L。下列判断正确的是
A. 从开始到平衡A的平均反应速率为0.3mol/(L![]() s)
s)
B. 从开始到平衡B的转化率为60%
C. 此反应的化学平衡常数表达式:![]()
D. 若混合气体的密度或压强不再改变时,该反应一定达到平衡状态
【答案】D
【解析】
2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol/L,生成C为0.2mol/L×2L=0.4mol,则![]() =
=![]() ,解得x=1,则
,解得x=1,则
3A(g)+B(g)C(g)+2D(s)
开始 3 1 0 0
转化 1.2 0.4 0.4 0.8
平衡 1.8 0.6 0.4 0.8
A.从开始到平衡A的平均反应速率为![]() =0.3mol/(L·min),故A错误;B.从开始到平衡B的转化率为
=0.3mol/(L·min),故A错误;B.从开始到平衡B的转化率为![]() ×100%=40%,故B错误;C.D为固体,此反应的化学平衡常数表达式K=
×100%=40%,故B错误;C.D为固体,此反应的化学平衡常数表达式K=![]() ,故C错误;D.D为固体,混合气体的质量为变量,由ρ=
,故C错误;D.D为固体,混合气体的质量为变量,由ρ=![]() 可知,密度为变量,则若混合气体的密度不再改变时,该反应一定达到平衡状态,反应恰好气体的物质的量发生变化,因此容器内气体的压强为变量,压强不变说明反应达到平衡状态,故D正确;故选D。
可知,密度为变量,则若混合气体的密度不再改变时,该反应一定达到平衡状态,反应恰好气体的物质的量发生变化,因此容器内气体的压强为变量,压强不变说明反应达到平衡状态,故D正确;故选D。


科目:高中化学 来源: 题型:
【题目】A、B、C、D是常见的有机物,A是一种气态烃,标准状况下的密度1.25g/L,其产量是衡量一个国家石油化工发展水平的标志之一;C分子式为C2H4O2;B和C在浓硫酸和加热条件下发生反应,生成有果香味儿的油状液体D;A、B、C、D一定条件下的转化关系如图(条件省略):

(1)C中所含官能团的名称______________;
(2)丙烯酸![]()
![]() 可能发生的化学反应有:__________________;
可能发生的化学反应有:__________________;
①加成反应 ②取代反应 ③加聚反应 ④中和反应 ⑤氧化反应
(3)写出聚丙烯酸的结构简式__________________________;
(4)写出下列反应的化学方程式:
①A→B:___________________________________________________;
②丙烯酸+B→丙烯酸乙酯:_______________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法错误的是
A. 11 g D![]() O所含的电子数为5NA
O所含的电子数为5NA
B. 常温下,5.6 g铁与浓硝酸反应转移的电子数为0.3NA
C. 甲烷燃料电池正极消耗标况下11.2L O2时,电路中通过的电子数为2NA
D. 3H2(g)+N2(g)![]() 2NH3(g) ΔH=-92 kJ·mol-1,当放出热量为92 kJ时,转移电子数为6NA
2NH3(g) ΔH=-92 kJ·mol-1,当放出热量为92 kJ时,转移电子数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 增大压强或升高温度,一定能使化学反应速率加快
B. 已知Ni(CO)4(g)=Ni(s)+4CO(g) ΔH=Q kJ/mol,则Ni(s)+4CO(g)=Ni(CO)4(g) ΔH=-Q kJ/mol
C. 500℃、30 MPa下,0.5 mol N2(g)和1.5 mol H2(g)反应生成NH3(g)放热Q kJ,其热化学方程式为N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-2Q kJ/mol
2NH3(g) ΔH=-2Q kJ/mol
D. 已知两个平衡体系:2NiO(s) ![]() 2Ni(s)+O2 (g),2CO(g)+O2(g)
2Ni(s)+O2 (g),2CO(g)+O2(g) ![]() 2CO2(g)的平衡常数分别为K1和K2,可推知平衡NiO(s)+CO(g)
2CO2(g)的平衡常数分别为K1和K2,可推知平衡NiO(s)+CO(g) ![]() Ni(s)+CO2(g)的平衡常数为
Ni(s)+CO2(g)的平衡常数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生反应:xA(g)+yB(s)![]() zC(g),平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30 mol/L。下列有关判断正确的是
zC(g),平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30 mol/L。下列有关判断正确的是
A. x<z B. 平衡向正反应方向移动
C. A的转化率降低 D. C的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验中需配制1.0 mol/L的NaOH溶液950 mL,假如其他操作均是准确无误,以下情况会引起配制溶液浓度偏高的是
A.称取40.0gNaOH固体
B.容量瓶水洗后未烘干直接使用
C.定容时俯视
D.摇匀后发现液面低于刻度线,继续加水至液面与刻度线平齐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从报废后的锂电池(主要成分为LiCoO2,此外含铁、铝、铜、锰、镍等)中回收有关物质,回收工艺流程如下:
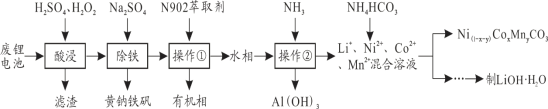
(1)操作②的名称为_______________,操作①的目的是___________________________。
(2)写出酸浸过程中LiCoO2发生氧化还原反应的化学方程式_______________________。
(3)室温下,各物质的Ksp如下表所示:(已知:lg2=0.3、1g6=0.8)
物质 | Al(OH)3 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 |
Ksp | 1×10-35 | 2×10-13 | 6×10-15 | 4×10-15 |
若水相中各金属离子浓度均为0.1mol/L,且离子浓度小于1.0×10-5mol/L,即认为该离子已完全除去,操作②需调节溶液pH的取值范围为_________。(保留1位小数)
(4)某锂离子电池正极材料含有LiNi1/3Co1/3Mn1/3O2,其中Ni、Co的化合价分别为+2、+3,则Mn的化合价为_______。该材料可通过回收的Ni(1-x-y)CoxMnyCO3与LiOH·H2O烧结得到,反应中不能隔绝空气,其原因是_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是原子序数依次增大的五种短周期主族元素,其中A的原子序数是B和D原子序数之和的1/4,C元素的单质与热水缓慢反应,且该单质可做铝热反应的引燃剂,甲和丙是D元素的两种常见氧化物,乙是B元素的单质,0.005mol/L丁溶液的pH=2,它们之间的转化关系如图所示(部分反应物省略),下列叙述正确的是
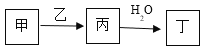
A. C、D的简单离子均能促进水的电离
B. C、E两元素形成化合物中既含有离子键又含共价键
C. A、D分别与B元素形成的化合物都是大气污染物
D. E的氧化物水化物的酸性大于D的氧化物水化物的酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中错误的是
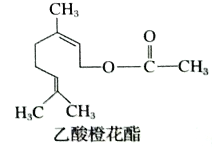
A. 分子式为C12H22O2
B. 能使酸性KMnO4溶液褪色,能发生加成反应和取代反应
C. 1mol该有机物水解时只能消耗1 mol NaOH
D. 1mol该有机物在一定条件下和H2反应,共消耗H2为2mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com