
【题目】从报废后的锂电池(主要成分为LiCoO2,此外含铁、铝、铜、锰、镍等)中回收有关物质,回收工艺流程如下:
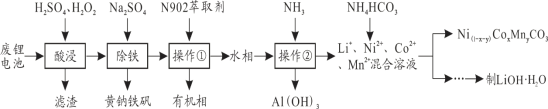
(1)操作②的名称为_______________,操作①的目的是___________________________。
(2)写出酸浸过程中LiCoO2发生氧化还原反应的化学方程式_______________________。
(3)室温下,各物质的Ksp如下表所示:(已知:lg2=0.3、1g6=0.8)
物质 | Al(OH)3 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 |
Ksp | 1×10-35 | 2×10-13 | 6×10-15 | 4×10-15 |
若水相中各金属离子浓度均为0.1mol/L,且离子浓度小于1.0×10-5mol/L,即认为该离子已完全除去,操作②需调节溶液pH的取值范围为_________。(保留1位小数)
(4)某锂离子电池正极材料含有LiNi1/3Co1/3Mn1/3O2,其中Ni、Co的化合价分别为+2、+3,则Mn的化合价为_______。该材料可通过回收的Ni(1-x-y)CoxMnyCO3与LiOH·H2O烧结得到,反应中不能隔绝空气,其原因是_______________________________________________________。
【答案】过滤 除铜 2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+4H2O+O2↑ 4.0≤pH<7.3(写4.0~7.3也可) +4 需要空气中的O2把其中+2价的Co和+2价的Mn氧化为更高的价态
【解析】
由流程图可知,废锂电池(主要成分为LiCoO2,此外含铁、铝、铜、锰、镍等),拆解后酸浸,加入过氧化氢还原+3价钴,过滤除去不溶性杂质,滤液加Na2SO4除铁(形成黄钠铁矾),加萃取剂萃取除铜,再通氨气,调节溶液pH沉淀铝离子过滤得到固体氢氧化铝;此时滤液中含有Li+、Ni2+、Co2+、Mn2+,再加NH4HCO3制LiOH![]() H2O,并回收Co。
H2O,并回收Co。
(1)根据上述工艺流程图得出,操作②的名称为过滤,操作①为萃取,其目的是除铜,
因此,本题正确答案是:过滤;除铜;
(2)LiCoO2和H2O2在酸性条件下发生氧化还原反应生成硫酸锂、硫酸钴、水和氧气,反应的化学方程式为:2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+4H2O+O2↑,
因此,本题正确答案是:2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+4H2O+O2↑;
(3)由上述工艺流程图可知,操作②需调节溶液pH的目的是使Al(OH)3沉淀完全,而Ni2+、Co2+、Mn2+不沉淀,
若使Al(OH)3沉淀完全,根据Ksp[Al(OH)3]=c(Al3+)c3(OH-),则c(OH-)=![]() =10-10mol/L,所以pH=-lg10-4=4.0,
=10-10mol/L,所以pH=-lg10-4=4.0,
若使Ni2+、Co2+、Mn2+不沉淀,由于Ni(OH)2溶度积最小,若Ni(OH)2不沉淀,则Co2+、Mn2+也不沉淀,根据Ksp[Ni(OH)2]=c(Ni2+)c2(OH-),则c(OH-)=![]() =2×10-7mol/L,
=2×10-7mol/L,
c(H+)=![]() =5×10-8,pH=-lg5×10-8=8-lg5=7.3,
=5×10-8,pH=-lg5×10-8=8-lg5=7.3,
调节溶液pH的取值范围为4.0≤pH<7.3,
因此,本题正确答案是:4.0≤pH<7.3;
(4)根据化合价代数和为0,LiNi1/3Co1/3Mn1/3O2中Ni、Co的化合价分别为+2、+3,设Mn的化合价为x。则1+(+2)![]() +(+3)
+(+3)![]() +x
+x![]() +(-2)×2=0,计算得x=+4,
+(-2)×2=0,计算得x=+4,
由Ni(1-x-y)CoxMnyCO3可知Co和Mn的化合价较低,需要O2将其氧化到较高价态,故通过回收的Ni(1-x-y)CoxMnyCO3与LiOH·H2O烧结得到LiNi1/3Co1/3Mn1/3O2,反应中不能隔绝空气,
因此,本题正确答案是:+4;需要空气中的O2把其中+2价的Co和+2价的Mn氧化为更高的价态。


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.金属元素在不同的化合物中化合价均相同
B.所有合金都只含有金属元素
C.可利用铝热反应冶炼单质镁
D.电解熔融氯化钠可以制得金属钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,在强酸性溶液中可以大量共存的是
A. Na+、Ca2+、SO42- B. Ag+、K+、NO3-
C. Ba2+、HCO3-、NO3- D. Na+、NO3-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+ 2D(s)。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol/L。下列判断正确的是
xC(g)+ 2D(s)。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol/L。下列判断正确的是
A. 从开始到平衡A的平均反应速率为0.3mol/(L![]() s)
s)
B. 从开始到平衡B的转化率为60%
C. 此反应的化学平衡常数表达式:![]()
D. 若混合气体的密度或压强不再改变时,该反应一定达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容下,向2L密闭容器中加入MgSO4和CO(g),发生反应:
MgSO4(s)+CO(g)![]() MgO(s)+CO2(g)+SO2(g),反应过程中测定的部分数据见下表:
MgO(s)+CO2(g)+SO2(g),反应过程中测定的部分数据见下表:
反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(CO2)/mol |
0 | 2.00 | 2.00 | 0 |
2 | 0.80 | ||
4 | 1.20 |
下列说法正确的是
A. 反应在0~2min内的平均速率为v(SO2)=0.6mol·L-1·min-1
B. 反应在2~4min内容器内气体的密度没有变化
C. 若升高温度,反应的平衡常数变为1.00,则正反应为放热反应
D. 保持其他条件不变,起始时向容器中充入1.00molMgSO4和1.00molCO,到达平衡时n(CO2)>0.60mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1molI2(g)和2molH2(g)置于某2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)![]() 2HI(g) △H<0,并达平衡,HI的体积分数ω(HI)随时间变化如图曲线
2HI(g) △H<0,并达平衡,HI的体积分数ω(HI)随时间变化如图曲线

(1)达平衡时,I2(g)的物质的量浓度为____________,H2(g)的平衡转化率为___________,在此温度下,该反应的平衡常数K=____________(保留一位小数)。
(2)若改变反应条件下,在甲条件下ω(HI)的变化如图曲线(I)所示,在乙条件下ω(HI)的变化如图曲线(III)所示。则甲条件可能是_________(填入下列条件的序号,下同),乙条件可能是__________。
① 恒容条件下,升高温度
② 恒容条件下,降低温度
③ 恒温条件下,缩小反应容器体积
④ 恒温条件下,扩大反应容器体积
⑤ 恒温恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2L密闭容器中加入a mol I2(g)、b mol H2和c mol HI(a、b、c均大于0),发生反应达平衡时,HI的体积分数仍为0.60,则a、b、c的应满足的关系是___________(用含一个a、b、c的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,前者属于电解质,后者属于非电解质的是( )
A. NaCl晶体、BaSO4 B. 铜、二氧化硫
C. 液态的醋酸、酒精 D. 熔融的KNO3、硫酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B 两种元素为同一族第三周期和第四周期元素,若 A 元素的原子序数为 x,则 B 元素的原子序数可能为( )
①x+2 ②x+8 ③x+18 ④x+32
A.③B.②C.②③D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期中的18种元素具有重要的用途,在现代工业中备受青睐。
(1)钛原子的价电子排布式为______________________,TiCl4沸点136℃,熔点-25℃,晶体类型为___________晶体。
(2)铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是______________________。
(3)与As同主族的短周期元素是N、P。AsH3中心原子轨道杂化的类型_________________;一定压强下将AsH3、NH3和PH3的混合气体降温时液化顺序是______________________,理由是______________________。
(4)铬是一种硬而脆抗腐蚀性强的金属,常用于电镀和制造特种钢。下图1为铬的晶胞结构图,则铬晶胞属于___________堆积;该晶胞中原子的体积占晶胞体积的百分率为___________。

(5)钴晶体的一种晶胞(如图2所示)的边长为anm,密度为ρg·cm-3,NA表示阿伏加德罗常数的值,则钴原子半径为___________mm,钴的相对原子质量可表示为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com