
【题目】丙烯腈(CH2=CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH2=CHCHO)和乙腈CH3CN 等,回答下列问题:
(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯睛(C3H3N)和副产物丙烯醛(CH2=CHCHO)的热化学方程式如下:
① C3H6(g)+NH3(g)+O2(g)=C3H3N(g)+3H2O(g)△H=-515kJ/mol
② C3H6(g)+O2(g)=C3H4O(g)+H2O(g) △H=-353kJ/mol
有利于提高丙烯腈平衡产率的反应条件是______;提高丙烯腈反应选择性的关键因素是_____.
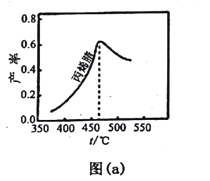
(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应温度为460℃。低于460℃时,丙烯腈的产率________(填“是”或者“不是”)对应温度下的平衡产率,判断理由是_____;高于460℃时,丙烯腈产率降低的可能原因是________(双选,填标号)。
A.催化剂活性降低 B.平衡常数变大 C.副反应增多 D. 反应活化能增大
(3)丙烯腈和丙烯醛的产率与n(氨)/n(丙烯)的关系如图(b)所示。由图可知,最佳n(氨)/n(丙烯)约为_________ ,理由是_______。进料氨、空气、丙烯的理论体积约为____________。

【答案】 降低温度、降低压强 催化剂 不是 该反应为放热反应,平衡产率应随温度升高而降低 AC 1 该比例下丙烯腈产率最高,而副产物丙烯醛产率最低 1:7.5:1
【解析】试题分析:(1)因为两个反应均为放热量大的反应,所以热力学趋势大;该反应为气体体积增大的放热反应,所以降低温度、降低压强有利于提高丙烯腈的平衡产率;由图b可知,提高丙烯腈反应选择性的关键因素是催化剂。
(2)因为该反应为放热反应,平衡产率应随温度升高而降低,反应刚开始进行,尚未达到平衡状态,460OC以前是建立平衡的过程,所以低于460OC时,丙烯腈的产率不是对应温度下的平衡产率;高于460OC时,丙烯腈产率降低,A.催化剂在一定温度范围内活性较高,若温度过高,活性降低,正确;B.平衡常数的大小不影响产率,错误;C.根据题意,副产物有丙烯醛,副反应增多导致产率下降,正确;D.反应活化能的大小不影响平衡,错误;答案选AC。
(3)根据图像可知,当n(氨)/n(丙烯)约为1时,该比例下丙烯腈产率最高,而副产物丙烯醛产率最低;根据化学反应C3H6(g)+NH3(g)+ 3/2O2(g)=C3H3N(g)+3H2O(g),氨气、氧气、丙烯按1:1.5:1的体积比加入反应达到最佳状态,而空气中氧气约占20%,所以进料氨、空气、丙烯的理论体积约为1:7.5:1。


科目:高中化学 来源: 题型:
【题目】将适量铁粉放入Fe2(SO4)3溶液中,完全反应后,溶液中的Fe3+和Fe2+浓度相等.则已经反应的Fe3+和未反应的Fe3+物质的量之比为( )
A.2:3
B.3:2
C.1:2
D.2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上CO2用于生产燃料甲醇,既能缓解温室效应,也为能源寻找了新渠道。合成甲醇的反应为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)。
(1)已知:CO的燃烧热△H=-283.0kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
CO(g)+2H2(g) ![]() CH3OH(g) △H=-90.1KJ/mol
CH3OH(g) △H=-90.1KJ/mol
则:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=___KJ/mol
CH3OH(g)+H2O(g) △H=___KJ/mol
(2)T℃时,测得不同时刻恒容密闭容器中CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度变化如下表所示
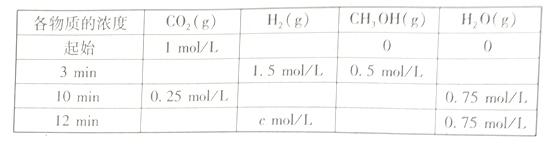
①c=___mol/L,从反应开始到平衡时,CH3OH的平均反应速率v(CH3OH)=__
②下列能说明该反应达到平衡状态的是____________
A.每消耗 1mol CO2的同时生成1 mol CH3OH
B.容器中气体的压强不再改变
C.混合气体的平均相对分子质量不发生变化
D.容器中气体的密度不再改变
(3)在催化剂作用下,若测得甲醇的产率与反应温度、压强的关系如下图所示:
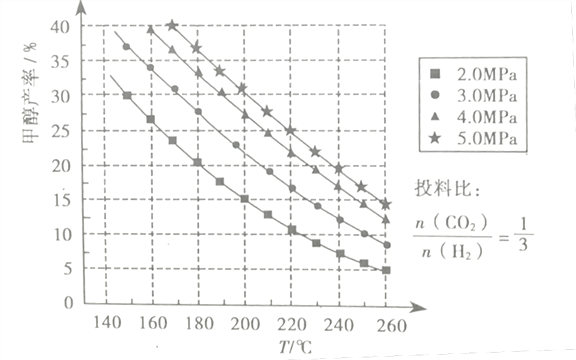
①分析图中数据可知,在220℃、5.0MPa时,CO2的转化率为__将温度降低至140℃、压强减小至2.0MPa,CO2的转化率将___(填“增大”、“减小”或“不变”)
②200℃、2.0MPa时,将amol/LCO2和3amol/LH2充入VL密闭容器中,在催化剂作用下反应达到平衡。根据图中数据计算所得甲醇的质量为___g(用含a的代数式表示)
(4)用NaOH溶液吸收CO2所得饱和碳酸钠溶液可以对废旧电池中的铅膏(主要成分PbSO4)进行脱硫反应。已知Ksp(PbSO4)=1.6x10-8,Ksp(PbCO3)=7.4×10-14,
PbSO4(s)+CO32-(aq) ![]() PbCO3(s)+SO42-(aq),则该反应的平衡常数K=______(保留三位有效数字);若在其溶液中加入少量Pb(NO3)2晶体,则c(SO42-):c(CO32-)的比值将______(填“增大”、“减小、”或“不变”)。
PbCO3(s)+SO42-(aq),则该反应的平衡常数K=______(保留三位有效数字);若在其溶液中加入少量Pb(NO3)2晶体,则c(SO42-):c(CO32-)的比值将______(填“增大”、“减小、”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤气中主要的含硫杂质有H2S以及COS(有机硫),煤气燃烧后含硫杂质会转化成SO2从而引起大气污染,因此煤气中H2S的脱出程度已成为煤气洁净度的一个重要指标。请回答下列问题:
(1)H2S在水溶液中的电离方程式为___________。
(2)脱除煤气中COS的方法有Br2的KOH溶液氧化法、H2还原法、水解法等。
①COS的分子结构与CO2相似,COS的结构式为___________。
②Br2的KOH溶液将COS氧化为硫酸盐的离子方程式为______________。
③已知:H2、COS、H2S、CO的燃烧热依次为285kJ/mol、299kJ/mol、586kJ/mol、283kJ/mol;H2还原COS发生的反应为H2(g)+COS(g)=H2S(g)+CO(g),该反应的ΔH=_________kJ/mol。
④用活性α-Al2O3催化COS水解反应为COS(g)+H2O(g) ![]() CO2(g)+H2S(g) ΔH<0,相同流量且在催化剂表面停留相同时间时,不同温度下COS的转化率(未达到平衡)如图1所示;某温度下,COS的平衡转化率与n(H2O)/n(COS)的关系如图2所示。
CO2(g)+H2S(g) ΔH<0,相同流量且在催化剂表面停留相同时间时,不同温度下COS的转化率(未达到平衡)如图1所示;某温度下,COS的平衡转化率与n(H2O)/n(COS)的关系如图2所示。
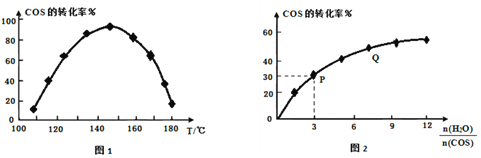
由图1可知,催化剂活性最大时对应的温度约为______,COS的转化率在后期下降的原因是_______________________________________。由图2可知,P点时平衡常数K=______(保留2位有效数字)。Q点转化率高于P点的原因是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用NaOH溶液滴定H2C2O4 溶液,溶液中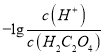 和-lgc(HC2O4-)或
和-lgc(HC2O4-)或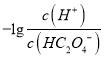 和-lgc(C2O42-)关系如图所示,下列说法正确的是
和-lgc(C2O42-)关系如图所示,下列说法正确的是
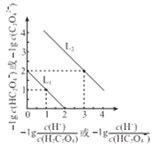
A. 曲线L1表示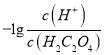 和-lgc(HC2O4-)的关系
和-lgc(HC2O4-)的关系
B. Ka2(H2C2O4)的数量级为10-2
C. NaHC2O4溶液中c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
D. 向0.1mol/LH2C2O4溶液中加入少量水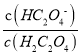 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: 25℃、101 kPa下:① 2 Na(s) + 1/2 O2(g) = Na2O(s) △H1 = - 414 kJ / mol
② 2 Na(s) + O2(g) = Na2O2(s) △H2 = - 511 kJ / mol
下列说法正确的是
A. ①和②产物的阴阳离子个数比不相等
B. ①和②生成等物质的量的产物,转移电子数不同
C. 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D. 25℃、101 kPa下,Na2O2(s) + 2 Na(s) = 2 Na2O(s) △H = -317 kJ / mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙烯推测丙烯的结构或性质,正确的是( )
A. 不能使酸性高锰酸钾溶液褪色,但能使溴水褪色
B. 分子中所有原子都在同一平面上
C. 与HCl加成只生成一种产物
D. 由丙烯之间的相互加成可得聚丙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 下列除去括号内杂质的有关操作正确的是
A. 苯(硝基苯):加少量蒸馏水震荡,待分层后分液
B. 乙醇(水):加新制生石灰,蒸馏
C. CO2(HCl、水蒸气):通过盛有碱石灰的干燥管
D. 乙烷(乙烯):通入氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸橙花酯是一种食用香料,其结构简式如图,关于该有机物的叙述中正确的是( )
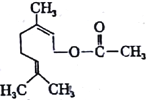
①1mol该有机物可消耗3molH2;②不能发生银镜反应;③分子式为C12H20O2;④它的同分异构体中可能有酚类;⑤1mol该有机物水解时只能消耗1molNaOH
A. ②③⑤ B. ①④⑤ C. ①②③ D. ②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com