
下列能说明氯元素比硫元素非金属性强的是 ( )
①HCl比H2S稳定;②HClO4酸性比H2SO4强;③Cl2能与H2S反应生成S;④Cl原子最外层有7个电子,S原子最外层有6个电子;⑤Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS;⑥盐酸是强酸,而氢硫酸是弱酸
A.①②③④⑤⑥ B.①②③④⑥ C.①②③⑤ D.②④⑥
 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
某有机物分子中含有下列基团:2个 、2个-CH2-、3个-CH3和一个-COOH,该有机物可能的结构有(不考虑立体异构)( )
、2个-CH2-、3个-CH3和一个-COOH,该有机物可能的结构有(不考虑立体异构)( )
A.8种 B.9种 C.10种 D.11种
查看答案和解析>>
科目:高中化学 来源: 题型:
现有由等质量的NaHCO3和KHCO3组成的混合物a g,与100 mL盐酸反应。(题中涉及的气体体积均以标准状况计,填空时可以用带字母的式子表示。)
(1)该混合物中NaHCO3与KHCO3的物质的量之比为________。
(2)如碳酸氢盐与盐酸恰好完全反应,则盐酸中HCl的物质的量为________mol。
(3)如果盐酸过量,生成CO2的体积为________L;
(4)如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成CO2的体积,还需要知道__________ _______________________________________________。
_______________________________________________。
(5)若NaHCO3和KHCO3不是以等质量混合,则a g固体混合物与足量的盐酸完全反应时生成CO2的体积[V(CO2)]范围是 ________________。
________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
元素性质呈周期性变化的决定因素是 ( )
A.元素原子核外电子层排布呈周期性变化 B.元素相对原子质量依次递增
C.元素原子半径大小呈周期性变化 D.元素的最高正化合价呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
已知4NH3+5O2==4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系是 ( )
A.4/5v(NH3)=v(O2) B.5/6v(O2)=v(H2O)C.2/3v(NH3)=v(H2O)D.4/5v(O2)=v(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
几种短周期元素的原子半径及某些化合价见下表。分析判断下列说法正确的是( )
| 元素代号 | A | B | D | E | G | I | J | K |
| 化合价 | –1 | –2 | +4 –4 | –1 | +5 –3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
A.A的单质能将E单质从KE的溶液中置换出来
B.A、I、J的离子半径由大到小顺序是A>J>I
C.G元素的单质不存在同素异形体
D.J在DB2中燃烧生成两种化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a:X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞溶液,则
①电解池中X电极上的电极反应式为_________________________在X电极附近观察到的现象是___________________________②Y电极上的电极反应式为____________________检验该电极反应产物的方法是___________________
(2)如用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是________,电极反应式为__________________②Y电极的材料是________,电极反应式为________(说明:杂质发生的电极反应不必写出)。

查看答案和解析>>
科目:高中化学 来源: 题型:
研究碳及其化合物的综合利用对促进低碳社会的构建具有重要的意义。请运用相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:______C+________K2Cr2O7+________——________CO2↑+________K2SO4+________Cr2(SO4)3+________H2O。
①完成并配平上述化学方程式。
②在上述化学方程式上标出该反应电子转移的方向与数目。
(2)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是_________________________________________________________。
②由MgO可制成“镁-次氯酸盐”燃料电池,其装置示意图如图(a)所示,该电池反应的离子方程式为________________________________________。
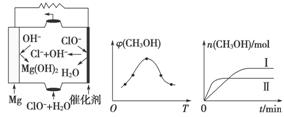
(a) (b) (c)
(3)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH。
①该反应的平衡常数表达式为K=________。
②取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图(b)所示,则上述CO2转化为甲醇反应的ΔH________(填“>”“<”或“=”)0。
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图(c)所示,曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ________KⅡ(填“>”“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com