
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:阅读理解
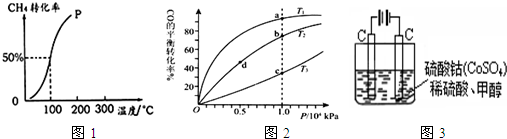
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
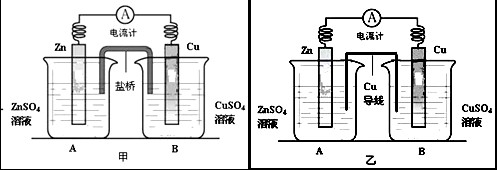
查看答案和解析>>
科目:高中化学 来源:读想用 高二化学(上) 题型:043
在一定温度下,对于难溶电解质AmBn,在水中可建立如下平衡:AmBn(固)![]() mAn++nBm-.
mAn++nBm-.
在一定温度下,当达到溶解平衡时,{c(An+)}m·{c(Bm-)}n为一常数,用Ksp表示,称为该温度下该难溶电解质的溶度积.在一定温度下,当{c(An+)}m·{c(Bm-)n=Ksp时,溶液呈饱和状态,沉淀质量既不增加,也不减少,当{c(An+)}m·{c(Bm-)}n>Ksp时,溶液呈过饱和状态,将析出沉淀;当{c(An+)}m·{c(Bm-)}n<Ksp时,溶液呈不饱和状态,沉淀将溶解.试根据上述原理,回答下面问题:
(1)已知在常温下FeS的Ksp=6.25×10-18,求此温度下FeS的溶解度(g/100 g水).(设饱和溶液的密度为1 g·mL-1)
(2)又知在常温下H2S饱和溶液中,c(H+)与c(S2-)间存在着以下关系:{c(H+)}2·c(S2-)=1.0×10-22.在该温度下,将适量FeS投入H2S饱和溶液中,欲使溶液中c(Fe2+)达到1 mol·L-1,应调节溶液的pH为多少?
查看答案和解析>>
科目:高中化学 来源:2014届江苏省高二下学期期中考试化学试卷(解析版) 题型:填空题
在80℃时,将0.4mol的A气体充入2L已抽空的固定容积的密闭容器中发生反应:A(g) mB(g)隔一段时间对该容器内的物质进行分析,得到如下数据:
mB(g)隔一段时间对该容器内的物质进行分析,得到如下数据:
|
时间(s) c(mol/L) |
0 |
20 |
40 |
60 |
80 |
100 |
|
c(A) |
0.20 |
0.14 |
0.10 |
c |
d |
e |
|
c(B) |
0.00 |
0.12 |
b |
0.22 |
0.22 |
0.22 |
⑴m= ,表中b c(填“<”、“=”或“>”)。
⑵100秒后若将容器的体积缩小至原来一半,平衡时B的浓度____________0.44 mol/L(填“<”、“=”或“>”)。
⑶在80℃时该反应的平衡常数K值为 (保留1位小数)。
⑷在其他条件相同时,该反应的K值越大,表明建立平衡时 。
①A的转化率越高 ②B的产量越大
③A与B的浓度之比越大 ④正反应进行的程度越大
查看答案和解析>>
科目:高中化学 来源: 题型:
在80℃时,将0.4mol的A气体充入2L已抽空的固定容积的密闭容器中发生反应:
A(g)![]() mB(g)隔一段时间对该容器内的物质进行分析,得到如下数据:
mB(g)隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) c(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(A) | 0.20 | 0.14 | 0.10 | c | d | e |
| c(B) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
⑴m= ,表中b c(填“<”、“=”或“>”)。
⑵100秒后若将容器的体积缩小至原来一半,平衡时B的浓度____________0.44 mol/L(填“<”、“=”或“>”)。
⑶在80℃时该反应的平衡常数K值为 (保留1位小数)。
⑷在其他条件相同时,该反应的K值越大,表明建立平衡时 。
①A的转化率越高 ②B的产量越大
③A与B的浓度之比越大 ④正反应进行的程度越大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com