
【题目】某同学设计实验探究工业制乙烯的原理和乙烯的主要化学性质,实验装置如图所示(已知烃类都不与碱反应)。请回答下列问题:
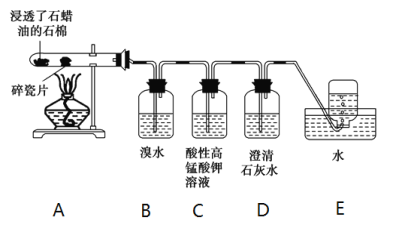
(1)工业制乙烯的实验原理是烷烃(液态)在催化剂和加热条件下发生反应生成不饱和烃。例如,石油分馏产物之一的十六烷烃发生反应:C16H34 ![]() C8H18+甲,甲
C8H18+甲,甲 ![]() 乙,乙的结构简式为_______。
乙,乙的结构简式为_______。
(2)B装置中发生反应的化学方程式:___________。
(3)C装置中可观察到的现象是________,反应类型是_________。
(4)查阅资料知,乙烯与酸性高锰酸钾溶液反应产生二氧化碳。本实验能证明这一点的实验现象__________。
(5)乙跟氢气的加成产物与一定量的氯气混合后在光照条件下反应,反应产物共有________。
【答案】CH2= CH2 CH2= CH2+Br2→BrCH2-CH2Br 紫色(或紫红色)褪去 氧化反应 D中的澄清石灰水变浑浊 10
【解析】
(1)依据原子守恒判断甲、乙物质,写出其分子式和结构简式;
(2)乙烯含有碳碳双键,能够与溴发生加成反应;
(3)乙烯具有还原性,能够被酸性高锰酸钾氧化;
(4)二氧化碳与氢氧化钙反应生成碳酸钙沉淀;
(5)结合甲烷与氯气的取代反应分析判断。
(1)工业制乙烯的实验原理是烷烃(液态)在催化剂和加热条件下发生反应生成不饱和烃。根据原子守恒,C16H34 ![]() C8H18+甲,所以甲分子式为:C8H16;依据方程式:C8H16
C8H18+甲,所以甲分子式为:C8H16;依据方程式:C8H16 ![]() 4乙,结合原子守恒可知,乙为:C2H4,为乙烯,结构简式为CH2=CH2,故答案为:CH2=CH2;
4乙,结合原子守恒可知,乙为:C2H4,为乙烯,结构简式为CH2=CH2,故答案为:CH2=CH2;
(2)乙烯含有碳碳双键,能够与溴发生加成反应而使溴水褪色,反应的化学方程式为:CH2=CH2+Br2→CH2Br-CH2Br,故答案为:CH2=CH2+Br2→CH2Br-CH2Br;
(3)乙烯具有还原性,能够被酸性高锰酸钾氧化发生氧化反应而使高锰酸钾褪色,故答案为:溶液的紫红色褪去;氧化反应;
(4)乙烯与酸性高锰酸钾溶液反应产生二氧化碳,二氧化碳能够与氢氧化钙反应生成碳酸钙沉淀,溶液变浑浊,因此D中的澄清石灰水变浑浊,可以证明乙烯与酸性高锰酸钾溶液反应产生了二氧化碳,故答案为:D中的澄清石灰水变浑浊;
(5)乙烯跟氢气的加成产物为乙烷,乙烷中含有6个氢原子,生成的有机物有一氯乙烷(1种)、二氯乙烷(2种)、三氯乙烷(2种)、四氯乙烷(2种)、五氯乙烷(1种)、六氯乙烷(1种),还有氯化氢,一共有10种生成物,故答案为:10。


科目:高中化学 来源: 题型:
【题目】四氯化锡(SnCl4)是一种重要的化工产品,可在加热下直接氯化来制备。已知:四氯化锡是无色液体,熔点-33 ℃,沸点114 ℃。SnCl4 极易水解,在潮湿的空气中发烟。实验室可以通过下图装置制备少量SnCl4 (夹持装置略)。
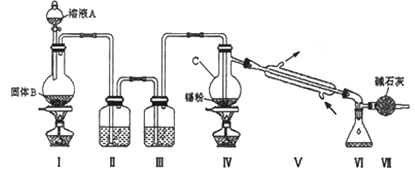
(1)装置Ⅰ中发生反应的离子方程式为________;
(2)装置Ⅱ中的最佳试剂为_______,装置Ⅶ的作用为_______;
(3)该装置存在的缺陷是:_______________;
(4)如果没有装置Ⅲ,在Ⅳ中除生成SnCl4外,还会生成的含锡的化合物的化学式为_______________;
(5)实验用锡粒中含有杂质Cu.某同学设计下列实验测定锡粒的纯度.
第一步:称取0.613g锡粒溶入足量盐酸中,过滤;
第二步:向滤液中加入过量FeCl3溶液,将Sn2+氧化成Sn4+;
第三步:用0.100 molL-1 K2Cr2O7溶液滴定生成的Fe2+,发生反应的表达式为(未配平):Fe2+ + Cr2O72- + H+→Cr3+ + Fe3+ + H2O
第二步中发生反应的离子方程式是 _______________,若达到滴定终点时共消耗16.0 mLK2Cr2O7溶液,试写出试样中锡的质量分数的计算式____________(仅写计算结果,锡的相对原子质量按119计算)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与浓硫酸表现出的性质(括号中)对应关系正确的是
A.在空气中敞口久置的浓硫酸,溶液质量增大(难挥发性)
B.在加热条件下铜与浓硫酸反应(强氧化性、酸性)
C.蔗糖与浓硫酸反应中有海绵状的炭生成(吸水性)
D.浓硫酸干燥氯气(脱水性)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)[化学——选修5:有机化学基础]
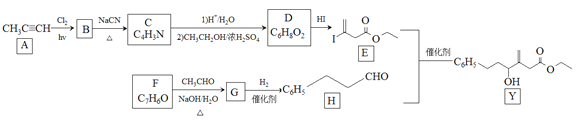
近来有报道,碘代化合物E与化合物H在Cr-Ni催化下可以发生偶联反应,合成一种多官能团的化合物Y,其合成路线如下:
已知:![]()
回答下列问题:
(1)A的化学名称是________________。
(2)B为单氯代烃,由B生成C的化学方程式为________________。
(3)由A生成B、G生成H的反应类型分别是________________、________________。
(4)D的结构简式为________________。
(5)Y中含氧官能团的名称为________________。
(6)E与F在Cr-Ni催化下也可以发生偶联反应,产物的结构简式为________________。
(7)X与D互为同分异构体,且具有完全相同官能团。X的核磁共振氢谱显示三种不同化学环境的氢,其峰面积之比为3∶3∶2。写出3种符合上述条件的X的结构简式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水热法制Fe3O4纳米颗粒的总反应为3Fe2+ + 2S2O32- + O2 + xOH- = Fe3O4 + S4O62- + 2H2O。下列说法正确的是( )
A. O2、S2O32-都是氧化剂
B. x=2
C. 将纳米Fe3O4颗粒分散在水中会产生丁达尔效应
D. 氧化产物只有S4O62-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.镀锡的铁片镀层破损后,腐蚀速率加快
B.Fe在食盐水中被腐蚀,其负极反应为O2 +2H2O + 4e-=4OH-
C.可用被保护金属与直流电源负极相接的方法来减慢腐蚀速率
D.电解法精炼铜时,阳极材料应用粗铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于SO2和CO2的说法中正确的是( )
A. 都是直线形结构
B. 中心原子都采用SP杂化轨道
C. SO2为V形结构,CO2为直线形结构
D. S原子和C原子上都没有孤对电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,当前氮的氧化物的污染日趋严重,某企业处理该污染物的原理设计为燃料电池如图所示。在处理过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用。下列说法不正确的是( )
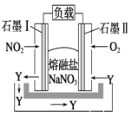
A. 该电池放电时电子流动的方向是:石墨Ⅰ电极→负载→石墨Ⅱ电极→熔融NaNO3→石墨Ⅰ电极
B. 石墨Ⅱ附近发生的反应:O2+4e-+2N2O5=4NO3-
C. O2在石墨Ⅱ附近发生还原反应,Y为N2O5
D. 相同条件下,放电过程中消耗的NO2和O2的体积比为4∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地湖盐中含有Ca2+、Mg2+、Fe3+、SO42-等杂质离子,氨碱厂用该地湖盐制取烧碱。其中制得精制食盐水的过程如下:

(1)过程Ⅰ中将粗盐加水溶解需要适当加热,其目的是__________。
(2)过程Ⅱ的目的是除去SO42-,加入的X溶液是__________。
(3)下表是过程Ⅱ、Ⅲ中生成的部分沉淀及其在20℃时的溶解度[g/100gH2O]
CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 | Fe(OH)3 |
2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 | 4.8×10-9 |
①过程Ⅲ中生成的主要沉淀除CaCO3和Fe(OH)3外还有__________。
②过程Ⅳ中调节pH时发生的主要反应的离子方程式为__________。
(4)上述精制食盐水中还含有微量的I-、IO3-、NH4+、Ca2+、Mg2+,除去这些离子及进行电解的流程如下:
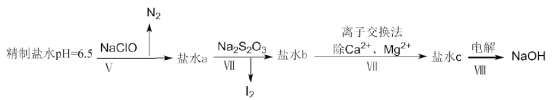
①过程V生成N2的离子方程式为__________。
②过程Ⅳ可以通过控制Na2S2O3的量,将IO3-还原成I2,且盐水b中含有SO42-,该过程中发生氧化还原反应,其中氧化剂和还原剂的物质的量之比为__________。
③在过程Ⅳ中所用的Na2S2O3俗称海波,是一种重要的化工原料。商品海波主要成分是Na2S2O3·5H2O。为了测定其含Na2S2O3·5H2O的纯度,称取8.00g样品,配成250mL溶液,取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol·L-1的碘水滴定(发生反应2S2O32-+I2=S4O62-+2I-),下表记录滴定结果:
滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
第一次 | 0.30 | 29.12 |
第二次 | 0.36 | 30.56 |
第三次 | 1.10 | 29.88 |
计算样品的纯度为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com