
【题目】四氯化锡(SnCl4)是一种重要的化工产品,可在加热下直接氯化来制备。已知:四氯化锡是无色液体,熔点-33 ℃,沸点114 ℃。SnCl4 极易水解,在潮湿的空气中发烟。实验室可以通过下图装置制备少量SnCl4 (夹持装置略)。
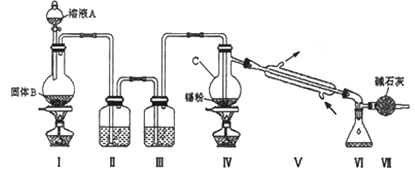
(1)装置Ⅰ中发生反应的离子方程式为________;
(2)装置Ⅱ中的最佳试剂为_______,装置Ⅶ的作用为_______;
(3)该装置存在的缺陷是:_______________;
(4)如果没有装置Ⅲ,在Ⅳ中除生成SnCl4外,还会生成的含锡的化合物的化学式为_______________;
(5)实验用锡粒中含有杂质Cu.某同学设计下列实验测定锡粒的纯度.
第一步:称取0.613g锡粒溶入足量盐酸中,过滤;
第二步:向滤液中加入过量FeCl3溶液,将Sn2+氧化成Sn4+;
第三步:用0.100 molL-1 K2Cr2O7溶液滴定生成的Fe2+,发生反应的表达式为(未配平):Fe2+ + Cr2O72- + H+→Cr3+ + Fe3+ + H2O
第二步中发生反应的离子方程式是 _______________,若达到滴定终点时共消耗16.0 mLK2Cr2O7溶液,试写出试样中锡的质量分数的计算式____________(仅写计算结果,锡的相对原子质量按119计算)
【答案】MnO2 + 4H+ + 2Cl- ![]() Mn2+ + Cl2↑ + 2H2O饱和氯化钠溶液防止空气中水蒸气进入装置,使SnCl4水解缺少尾气处理装置Sn(OH)4或SnO22Fe3+ + Sn2+ = Sn4+ + 2Fe2+93.18%
Mn2+ + Cl2↑ + 2H2O饱和氯化钠溶液防止空气中水蒸气进入装置,使SnCl4水解缺少尾气处理装置Sn(OH)4或SnO22Fe3+ + Sn2+ = Sn4+ + 2Fe2+93.18%
【解析】
由装置图可知装置Ⅰ应为制备氯气的装置,装置Ⅱ和装置Ⅲ是氯气的净化装置,氯气经除杂,干燥后与锡在装置Ⅳ中反应生成SnCl4,经冷却后在装置Ⅵ中收集,因SnCl4极易水解,应防止空气中的水蒸气进入装置Ⅵ中。(5)用已知浓度的K2Cr2O7滴定生成的Fe2+,根据原子守恒、电子转移守恒可得关系式:Sn~Sn2+~2Fe3+~2Fe2+~![]() K2Cr2O7,据此分析解答。
K2Cr2O7,据此分析解答。
(1)装置Ⅰ中浓盐酸与MnO2在加热时发生反应产生氯气,发生反应的离子方程式为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)由于盐酸有挥发性,所以在制取的氯气中含有杂质HCl,在与金属锡反应前要除去,因此装置Ⅱ中的最佳试剂为除去HCl同时还可以减少氯气消耗的饱和食盐水;SnCl4极易水解,在潮湿的空气中发烟,为了防止盐水解,所以要防止起水解,装置Ⅶ的作用为防止空气中的水蒸气进入Ⅵ中使SnCl4水解,故答案为:饱和氯化钠溶液;防止空气中水蒸气进入Ⅵ中,SnCl4水解;
(3)未反应的氯气没有除去,缺少尾气处理装置,故答案为:缺少尾气处理装置;
(4)如果没有装置Ⅲ,则在氯气中含有水蒸汽,所以在Ⅳ中除生成SnCl4外,还会生成SnCl4水解产生的含锡的化合物Sn(OH)4或SnO2,故答案为:Sn(OH)4或SnO2等;
(5)滴定过程中的反应方程式为6Fe2+ + Cr2O72- + 14H+=2Cr3+ + 6Fe3+ + 7H2O,第二步中加入过量FeCl3溶液,将Sn2+氧化成Sn4+,反应的方程式为2Fe3+ + Sn2+ = Sn4+ + 2Fe2+,令锡粉中锡的质量分数为x,则:
Sn~Sn2+~2Fe3+~2Fe2+~![]() K2Cr2O7
K2Cr2O7
119g ![]() mol
mol
0.613xg 0.100 molL-1×0.016L
故![]() =
=![]() ,解得x=93.18%,故答案为:93.18%。
,解得x=93.18%,故答案为:93.18%。


科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,△H能正确表示物质的燃烧热的是
A.C(s) +1/2O2(g)=CO(g) △H=-110.5 kJ/mol
B.CO(g) +1/2O2(g)=CO2(g) △H=-283.0 kJ/mol
C.H2(g) +1/2O2(g)=H2O(g) △H=-241.8 kJ/mol
D.2C8H18(l) +25O2(g)=16CO2(g)+18H2O(l) △H=-11036 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们应用原电池原理制作了多种电池,以满足不同的需要,广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格。
(1)铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4===2PbSO4+2H2O。正极电极反应为__________。
(2)某学习小组依据氧化还原反应:2Ag++Cu===Cu2++2Ag设计成原电池,则负极发生的电极反应为 ________,当反应进行到一段时间后取出电极材料,测得某一电极增重了5.4g,则该原电池反应共转移了的电子数目是_________。
(3)燃料电池是一种高效、环境友好的供电装置,如下图是电解质为稀硫酸溶液的氢氧燃料电池原理示意图,回答下列问题:

①该电池的正极反应式__________________________。
②若该电池的效率80%,当外电路通过0.2mo1电子时,消耗O2的体积____L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向FeCl3溶液中滴加2滴KSCN溶液,发生反应达到平衡Ⅰ。保持温度不变,仅改变某一个条件达到平衡Ⅱ,两次平衡时各物质的浓度如下:
Fe3+(aq)+3SCN-(aq)![]() Fe(SCN)3(aq)
Fe(SCN)3(aq)
平衡Ⅰ/(mol·L-1) a b c
平衡Ⅱ/(mol·L-1) x y z
下列叙述不正确的是( )
A. 存在关系式:c/ab3=z/xy3
B. 存在关系式:(a-x)∶(b-y)∶(z-c)=1∶3∶1
C. 向溶液中加入少量铁粉,溶液颜色变浅
D. 当溶液中c(SCN-)保持不变时达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对尼古丁和苯并[a]芘的分子组成与结构描述正确的是

A. 尼古丁的分子式为C10H12N2
B. 尼古丁为芳香族化合物
C. 苯并[a]芘分子中含有苯环结构单元,是苯的同系物
D. 尼古丁分子中的所有氢原子一定不在同一平面上,苯并[a]芘分子中所有氢原子都在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质分类的说法正确的是
A.HNO3、CO2、CaCO3都属于酸B.金刚石、白磷都属于单质
C.SO2、SiO2、CO均属于酸性氧化物D.金属氧化物均为碱性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 摩尔是物质的量的单位
B. 摩尔是一个基本物理量
C. N2的摩尔质量为28g
D. 0.1 mol NaCl溶解在IL水中,所得溶液中NaCl的物质的量浓度为0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计实验探究工业制乙烯的原理和乙烯的主要化学性质,实验装置如图所示(已知烃类都不与碱反应)。请回答下列问题:
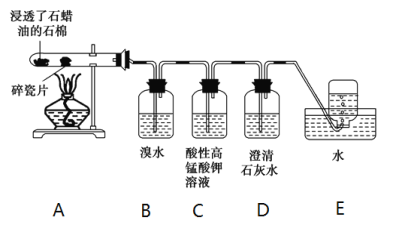
(1)工业制乙烯的实验原理是烷烃(液态)在催化剂和加热条件下发生反应生成不饱和烃。例如,石油分馏产物之一的十六烷烃发生反应:C16H34 ![]() C8H18+甲,甲
C8H18+甲,甲 ![]() 乙,乙的结构简式为_______。
乙,乙的结构简式为_______。
(2)B装置中发生反应的化学方程式:___________。
(3)C装置中可观察到的现象是________,反应类型是_________。
(4)查阅资料知,乙烯与酸性高锰酸钾溶液反应产生二氧化碳。本实验能证明这一点的实验现象__________。
(5)乙跟氢气的加成产物与一定量的氯气混合后在光照条件下反应,反应产物共有________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com