
【题目】某地湖盐中含有Ca2+、Mg2+、Fe3+、SO42-等杂质离子,氨碱厂用该地湖盐制取烧碱。其中制得精制食盐水的过程如下:

(1)过程Ⅰ中将粗盐加水溶解需要适当加热,其目的是__________。
(2)过程Ⅱ的目的是除去SO42-,加入的X溶液是__________。
(3)下表是过程Ⅱ、Ⅲ中生成的部分沉淀及其在20℃时的溶解度[g/100gH2O]
CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 | Fe(OH)3 |
2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 | 4.8×10-9 |
①过程Ⅲ中生成的主要沉淀除CaCO3和Fe(OH)3外还有__________。
②过程Ⅳ中调节pH时发生的主要反应的离子方程式为__________。
(4)上述精制食盐水中还含有微量的I-、IO3-、NH4+、Ca2+、Mg2+,除去这些离子及进行电解的流程如下:
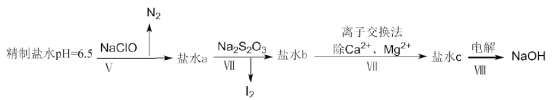
①过程V生成N2的离子方程式为__________。
②过程Ⅳ可以通过控制Na2S2O3的量,将IO3-还原成I2,且盐水b中含有SO42-,该过程中发生氧化还原反应,其中氧化剂和还原剂的物质的量之比为__________。
③在过程Ⅳ中所用的Na2S2O3俗称海波,是一种重要的化工原料。商品海波主要成分是Na2S2O3·5H2O。为了测定其含Na2S2O3·5H2O的纯度,称取8.00g样品,配成250mL溶液,取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol·L-1的碘水滴定(发生反应2S2O32-+I2=S4O62-+2I-),下表记录滴定结果:
滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
第一次 | 0.30 | 29.12 |
第二次 | 0.36 | 30.56 |
第三次 | 1.10 | 29.88 |
计算样品的纯度为__________。
【答案】加快物质溶解 BaCl2溶液 BaCO3、Mg2(OH)2CO3 CO32-+2H+=CO2↑+H2O 2NH4++3ClO-=N2↑+3Cl-+2H++3H2O 8:5 89.28%
【解析】
粗盐在加热条件下溶解后加入氯化钡溶液,可除去SO42-,生成沉淀为BaSO4,滤液再加入碳酸钠,可生成CaCO3、Fe(OH)3、BaCO3、Mg2(OH)2CO3等沉淀,溶液中含有CO32-,加入盐酸除去CO32-,可得到精制盐水,以此解答(1)~(3);(4)精制食盐水中还含有微量的I-、IO3-、NH4+、Ca2+、Mg2+,加入NaClO氧化NH4+生成氮气,然后加入Na2S2O3,将IO3-还原为I2,盐水b中含有Ca2+、Mg2+等,可用离子交换法除去,电解可得到氢氧化钠溶液,以此解答该题。
(1)将粗盐加水溶解需要适当加热,温度升高,可加快物质溶解;
(2)除去SO42-,可加入BaCl2溶液,生成BaSO4沉淀,即X为BaCl2溶液;
(3)①由表中数据可知,过程Ⅲ中生成的主要沉淀除CaCO3、Fe(OH)3外还有BaCO3、Mg2(OH)2CO3;
②滤液中含有过量的碳酸钠,过程Ⅳ中调节pH时发生的主要反应的离子方程式为CO32-+2H+=CO2↑+H2O;
(4)①加入NaClO氧化铵根生成氮气,方程式为2NH4++3ClO-=N2↑+3Cl-+2H++3H2O;
②加入Na2S2O3的量,将IO3-还原成I2,且盐水b中含有SO42-,可知反应中IO3-为氧化剂,化合价由+5价降低到0价,Na2S2O3为还原剂,反应中S元素化合价由+2价升高到+6价,总共升高8价,则氧化剂和还原剂的物质的量之比为8:5;
③表中第二次实验数据误差较大,可舍去,则其它两次平均值为(29.12-0.30+29.88-1.10)mL/2=28.80mL,则n(I2)=0.0288L×0.0500molL-1=1.44×10-3mol,由反应2S2O32-+I2=S4O62-+2I-可知25.00mL溶液中n(Na2S2O3)=2.88×10-3mol,则250mL溶液中含有0.0288mol Na2S2O3,则8.00g样品中Na2S2O3的纯度为(0.0288mol×248g/mol)/8g×100%=89.28%。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某同学设计实验探究工业制乙烯的原理和乙烯的主要化学性质,实验装置如图所示(已知烃类都不与碱反应)。请回答下列问题:
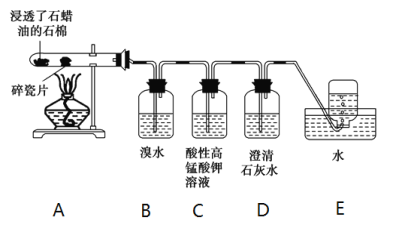
(1)工业制乙烯的实验原理是烷烃(液态)在催化剂和加热条件下发生反应生成不饱和烃。例如,石油分馏产物之一的十六烷烃发生反应:C16H34 ![]() C8H18+甲,甲
C8H18+甲,甲 ![]() 乙,乙的结构简式为_______。
乙,乙的结构简式为_______。
(2)B装置中发生反应的化学方程式:___________。
(3)C装置中可观察到的现象是________,反应类型是_________。
(4)查阅资料知,乙烯与酸性高锰酸钾溶液反应产生二氧化碳。本实验能证明这一点的实验现象__________。
(5)乙跟氢气的加成产物与一定量的氯气混合后在光照条件下反应,反应产物共有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某晶体的晶胞结构为正三棱柱(如图所示),这种晶体中A、B、C三种微粒数目之比为( )

A. 1∶4∶2 B. 3∶9∶4
C. 2∶9∶4 D. 3∶8∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年12月7日12时12分,我国成功的用长征二号丁运载火箭将沙特等国的12颗卫星一次性送入预定轨道,标志着我国一箭多星发射技术已经达到国际领先水平。火箭推进器常用强还原剂液态肼(N2H4)和强氧化剂液态双氧水来产生推力。
(1)已知肼分子中每个原子的最外层电子都达到了稳定结构,请写出肼的结构式:________。
(2)肼-空气燃料电池是一种环保的碱性燃料电池,电解质溶液是20%~30%的KOH溶液.
肼-空气燃料电池放电时负极的电极反应式是________________________。
(3)由18O、16O、H、D原子组成的H2O2分子共有10种,这10种分子中共有_______种相对分子质量。
(4)一种用H2O2处理剧毒物质NaCN的化学方程式是NaCN+H2O2→N2↑+X+H2O,则X的化学式是____________。
(5)强氧化剂液态H2O2也可以用NO2、或F2代替,试写出N2H4与F2的化学反应方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)中,4 mol HCl被氧化,放出115.6 kJ的热量。又知:
2Cl2(g)+2H2O(g)中,4 mol HCl被氧化,放出115.6 kJ的热量。又知:![]() ,判断下列说法正确的是( )
,判断下列说法正确的是( )
A. 该反应的ΔH=+115.6 kJ·mol-1
B. 断开1 mol H—O 键与断开1 mol H—Cl 键所需能量相差约为32 kJ
C. H2O中H—O 键比HCl中H—Cl键弱
D. 由所提供数据判断氯元素的非金属性比氧元素强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X元素的阳离子和Y元素的阴离子具有与氖原子相同的电子层结构,下列说法正确的是
A. 原子序数X<Y B. 原子半径X>Y
C. 原子的最外层电子数X>Y D. 元素的最高正价X<Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 《元丰行示德逢》里“雷蟠电掣云滔滔,夜半载雨输亭皋”涉及化学反应N2+O2![]() 2NO
2NO
B. 检验久置 Na2SO3是否变质,可用BaCl2溶液和稀硝酸
C. SO2通入BaCl2溶液中会产生白色沉淀
D. 将铜片放入浓硫酸中,无明显现象是因为铜片发生了钝化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源可分为一级能源和二级能源,自然界中以现成形式提供的能源称为一级能源,需依靠其他能源的能量间接制取的能源称为二级能源。据此判断,下列叙述正确的是
A. 天然气是二级能源 B. 石油是二级能源
C. 电能是一级能源 D. 水力是一级能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量。

(1)A中试剂为________。
(2)B中发生反应的化学方程式为_______________。
(3)若实验用铝镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况),B中剩余固体的质量为c g,则铝的相对原子质量为____________________。
(4)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数(用a、c表示)将________(填“偏大”、“偏小”或“不受影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com