
| A、具有下列电子排布式的原子中,①1s22s22p63s23p2②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4 原子半径最大的是① |
| B、具有下列价电子排布式的原子中,①3s23p1 ②3s23p2 ③3s23p3 ④3s23p4,第一电离能最大的是③ |
| C、①Na、K、Rb ②O、S、Se ③Na、P、Cl,元素的电负性随原子序数增大而递增的是③ |
| D、某元素气态基态原子的逐级电离能分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X3+ |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、在化学反应中要考虑“原子经济性”以提高效率 |
| B、资源的开发和利用,要考虑可持续发展的原则 |
| C、要加强对工业“三废”的治理,以保护环境 |
| D、将废弃的塑料袋回收进行露天焚烧,以解决“白色污染”问题 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaCl | MgCl2 | AlCl3 | SiCl4 | |
| 熔点/℃ | 801 | 714 | 190 | -70 |
| 沸点/℃ | 1 413 | 1 412 | 180 | 57.57 |
| A、①② | B、②③ | C、①②④ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2Na+2H2O=2NaOH+H2↑ |
| B、2Na2O2+2H2O=4NaOH+O2↑ |
| C、3NO2+H2O=2HNO3+NO |
| D、2Cl2+2H2O=4HCl+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B |
| C |
| A、B与C均存在同素异形体 |
| B、X的种类比Y的多 |
| C、C的最高价氧化物对应水化物能与A的氢化物形成三种盐 |
| D、沸点:A的氢化物低于C的氢化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向碳酸氢钙溶液中加入足量氨水:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
| B、次氯酸钠溶液通入二氧化硫气体:2ClO-+SO2+H2O═2HClO+SO32- |
| C、向KI与稀硫酸的混合溶液中通入氧气:4H++O2+4I-═2I2+2H2O |
| D、小苏打溶液中加入过量石灰水:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 强热 |
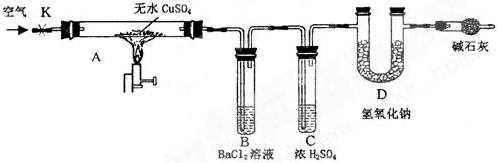
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com