
【题目】ZrO2常用作陶瓷材料,可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO·SiO2, 还含少量Fe2O3、A12O3、SiO2等杂质)通过如下方法制取。
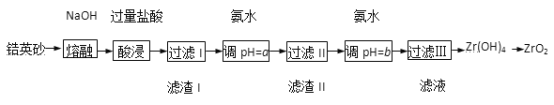
已知:ZrO2能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+。
(1)在熔融时NaOH和ZrSiO4发生反应的化学方程式为________________,滤渣I的化学式为_______。
(2)用氨水调pH=a是为了使滤液I的杂质离子_______(填离子符号)完全沉淀,而ZrO2+不沉淀;继续加氨水至pH=b时,所发生反应的离子方程式为____________________________。
(3)过滤III所得滤液含有NH4Cl,向其中加入CaCO3粉末并加热,可得到两种气体。该反应的离子方程式为_______________。
(4)为得到纯净的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是______________。
【答案】 ZrSiO4+4NaOH![]() Na2SiO3+Na2ZrO3+2H2O H2SiO3(或 H4SiO4) Fe3+、Al3+ ZrO2++2NH3 H2O+H2O =Zr(OH)4↓+2NH4+ 2NH4++CaCO3=Ca2++2NH3↑+CO2↑+H2O 取最后一次洗涤液,向其中滴加稀硝酸,再滴加硝酸银溶液,若无沉淀生成,则Zr(OH)4洗涤干净
Na2SiO3+Na2ZrO3+2H2O H2SiO3(或 H4SiO4) Fe3+、Al3+ ZrO2++2NH3 H2O+H2O =Zr(OH)4↓+2NH4+ 2NH4++CaCO3=Ca2++2NH3↑+CO2↑+H2O 取最后一次洗涤液,向其中滴加稀硝酸,再滴加硝酸银溶液,若无沉淀生成,则Zr(OH)4洗涤干净
【解析】(1)锆英砂在NaOH熔融下,生成Na2ZrO3、Na2SiO3、Na[Al(OH)4],Fe2O3不溶,再加入HCl酸浸时,Fe2O3溶解生成Fe3+,Na2ZrO3转化成ZrO2+,Na2SiO3转化成H2SiO3沉淀,Na[Al(OH)4]转化成Al3+,ZrSiO4与NaOH反应为非氧化还原反应,根据元素守恒可配平反应:ZrSiO4+4NaOH![]() Na2SiO3+Na2ZrO3+2H2O;(2)加入氨水,使Fe3+、Al3+杂质除去,但不可使ZrO2+沉淀,所以pH的范围为5.2~6.2。继续加入氨水,使ZrO2+转化为Zr(OH)4沉淀,所发生反应的离子方程式为ZrO2++2NH3 H2O+H2O =Zr(OH)4↓+2NH4+;(3) NH4+水解显酸性,加入CaCO3可生成CO2,同时促进了NH4+水解,生成NH3:2NH4++CaCO3=Ca2++2NH3↑+CO2↑+H2O ;(4)过滤Ⅲ处的滤液为NH4Cl,Zr(OH)4沉淀是否洗涤干净,只要检验滤液中是否含有Cl-即可。检验Zr(OH)4是否洗涤干净的方法是:取最后一次洗涤液,向其中滴加稀硝酸,再滴加硝酸银溶液,若无沉淀生成,则Zr(OH)4洗涤干净。
Na2SiO3+Na2ZrO3+2H2O;(2)加入氨水,使Fe3+、Al3+杂质除去,但不可使ZrO2+沉淀,所以pH的范围为5.2~6.2。继续加入氨水,使ZrO2+转化为Zr(OH)4沉淀,所发生反应的离子方程式为ZrO2++2NH3 H2O+H2O =Zr(OH)4↓+2NH4+;(3) NH4+水解显酸性,加入CaCO3可生成CO2,同时促进了NH4+水解,生成NH3:2NH4++CaCO3=Ca2++2NH3↑+CO2↑+H2O ;(4)过滤Ⅲ处的滤液为NH4Cl,Zr(OH)4沉淀是否洗涤干净,只要检验滤液中是否含有Cl-即可。检验Zr(OH)4是否洗涤干净的方法是:取最后一次洗涤液,向其中滴加稀硝酸,再滴加硝酸银溶液,若无沉淀生成,则Zr(OH)4洗涤干净。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】已知氧化性顺序是:Cl2﹥Br2﹥Fe3+﹥I2,在FeI2和FeBr2混合溶液中,通入一定量Cl2,溶液中存在的离子组不合理的是( )
A.Fe3+ Br- Cl- B.Fe2+ Br- Cl-
C. Fe2+ Cl- I- D.Fe2+ Br- Cl- I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的。
阳离子 | K+、Na+、Cu2+、Al3+ |
阴离子 | SO42-、HCO3-、NO3-、OH- |
为了鉴别上述化合物,分别完成以下实验,其结果是
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,仅有B、C为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,只有A中放出无色气体,只有C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验填空:
(1)写出B、D的化学式:B________,D________。
(2)将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为__________________________。
(3)C常用作净水剂,用离子方程式表示其净水原理:________________________。
(4)在A溶液中加入少量澄清石灰水,其离子方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示的是钢铁在海水中的锈蚀过程,以下有关说法正确的是( )

A. 该金属腐蚀过程为析氢腐蚀
B. 正极为C,发生的反应为氧化反应
C. 在酸性条件下发生的是吸氧腐蚀
D. 正极反应为O2+2H2O+4e-===4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学组装了如图所示的电化学装置,其中电极I为Al,其它均为Cu,下列说法正确的是( )

A. 装Al2(SO4)3溶液的烧杯是原电池,其余两个为电解(电镀)池
B. 盐桥中电子从右侧流向左侧
C. 电极II逐渐溶解
D. 电极IV的电极反应:Cu2+ + 2e-= Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求。
某同学按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol·L-1的KBr溶液、KI(含淀粉)溶液、NaOH(含酚酞)溶液、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心e处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好。
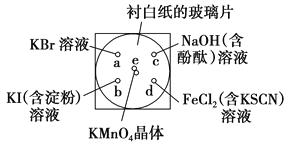
(1)e处反应的离子方程式为____________________________。
(2)b处的实验现象为_________________________________________。
(3)c处反应的化学方程式为____________________________________________。
标准状况下,当有0.224 L Cl2被NaOH溶液吸收后,转移电子的物质的量为________mol。
(4)通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱?________(填“能”或“不能”),若能,其氧化性由强到弱的顺序是________________。
II. 据报道,有一种细菌在有氧气存在的酸性溶液中,可将黄铜矿CuFeS2氧化成硫酸盐:4CuFeS2+2H2SO4+17O2===4CuSO4+2Fe2(SO4)3+2H2O。利用反应后的溶液,按如下流程可制备胆矾(CuSO4·5H2O):
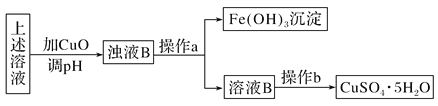
①检验溶液B中Fe3+是否被除尽的实验方法
_________________________________________________________________。
②在实验室中,设计两个原理不同的方案,从溶液B中提炼金属铜(要求:一种方案只用一个反应来完成)。写出两种方案中涉及的化学方程式:
方案一:_________________________________________________________;
方案二:_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检验SO2气体中是否混有CO2气体,可采用的方法是( )
A. 通过品红溶液
B. 通过澄清石灰水
C. 先通过氢氧化钠溶液,再通过澄清石灰水
D. 先通过酸性高锰酸钾溶液,再通过澄清石灰水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,设计了如图的装置。试回答下列问题:

(1)电源中电极a的名称是__________。(正极、负极)
(2)氯气被吸收时所发生反应的化学方程式为_______________。
(3)检验Cl2是否吸收完全,可采用的方法是______________。
(4)研究表明,当NaCl刚好电解完时,溶液中只有一种溶质,则该溶质最有可能是________________。由此可以用一个化学方程表示该容器中所发生的化学反应,该化学方程式为_______________。
(5)NaCl中往往含有CaCl2、MgSO4杂质,为了除去上述杂质,可选用A:BaCl2、B:Na2CO3、C:NaOH、D:HCl。
使用试剂正确的顺序为(________________________)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学组装了如图所示的电化学装置,其中电极I为Al,其它均为Cu,下列说法正确的是( )

A. 装Al2(SO4)3溶液的烧杯是原电池,其余两个为电解(电镀)池
B. 盐桥中电子从右侧流向左侧
C. 电极II逐渐溶解
D. 电极IV的电极反应:Cu2+ + 2e-= Cu
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com