
| A、向FeBr2溶液中通入过量氯气:2Fe2++Cl2=2Fe3++2Cl- |
| B、向稀硫酸加入少量Ba(OH)2溶液:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
| C、碳酸氢铵溶液与足量的NaOH溶液共热,NH4++OH-?NH3↑+H2O |
| D、鸡蛋壳和醋酸溶液的主要反应:CaCO3+2H+=Ca2++H2O+CO2↑ |


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下0.4 mol/L HB溶液和0.2 mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(Na+)>c(B-)>c(H+)>c(OH-) |
| B、常温时,pH=2的CH3COOH溶液和HCl溶液、pH=12的氨水和NaOH溶液,四种溶液中由水电离的c(H+)不相等 |
| C、pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 |
| D、0.lmol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁有剩余,溶液呈浅绿色,Cl-浓度基本不变 |
| B、往溶液中滴入KSCN无色溶液,不显红色 |
| C、氧化产物与还原产物的物质的量之比为2:5 |
| D、Fe2+、Fe3+的物质的量之比为6:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、锌片插入硝酸银溶液中:Zn+Ag+═Zn2++Ag |
| B、将氯气溶于水制备次氯酸:Cl2+H2O═2H++Cl-+ClO- |
| C、少量金属钠加到冷水中:Na+2H2O═Na++OH-+H2↑ |
| D、氢氧化铜加到盐酸中:Cu(OH)2+2H+═Cu2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| A、0<Q1<Q2 | ||
| B、上述反应中反应物总能量均高于生成物总能量 | ||
| C、氢气的标准燃烧热是a kJ?mol-1,碳的标准燃烧热是Q2kJ?mol-1 | ||
D、a>b=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
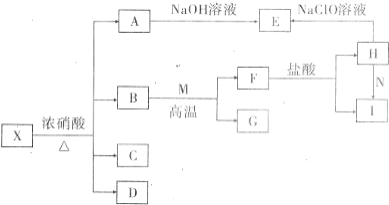 固体X是由两种常见元素组成的化合物.其中金属元素与另一元素的质量比为14:1.在一定条件下X可发生如下转化(部分产物未标出).C是无色无昧且能使澄清石灰水变浑浊的气体,D为红棕色气体,E为红褐色沉淀,M为常见金属单质.
固体X是由两种常见元素组成的化合物.其中金属元素与另一元素的质量比为14:1.在一定条件下X可发生如下转化(部分产物未标出).C是无色无昧且能使澄清石灰水变浑浊的气体,D为红棕色气体,E为红褐色沉淀,M为常见金属单质.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com