
【题目】下图是部分短周期元素最外层电子数与原子序数的关系图。

请回答下列问题:
(1)画出Z的原子结构示意图__________________。
(2)原子半径:Y____Z(填“>”、“<”)。
(3)Y的最高价氧化物的水化物与氢氧化钠溶液反应的化学方程式为_________。
(4)X的最高价氧化物的水化物的化学式为_________。
(5)画出W的氢化物的电子式____________。
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F、G七种元素,它们的原子序数依次增大。A在所有元素中原子半径最小;B原子核外电子有6种不同运动状态;D与C、E均相邻;A、D、E三种元素的原子序数之和为25;E2-和F+有相同的核外电子排布;G的质子数是25。请回答下列问题:
(1)写出元素G的基态原子外围电子排布式________;B、C、D三种元素分别形成的最简单氢化物的沸点最高的是________(用化学式表示)。
(2)由上述元素中的两种元素组成的一种阴离子与D的一种同素异形体分子互为等电子体,该阴离子化学式为________。
(3)由上述元素组成的属于非极性分子且VSEPR为直线形的微粒的电子式________(任写一种)。
(4)M是由4个C原子组成的一种不稳定的多原子单质分子,M分子中C原子杂化方式为sp3杂化,M分子的立体构型为________。
(5)某一次性电池的比能量和可储存时间均比普通干电池优良,适用于大电流和连续放电,是民用电池的升级换代产品之一,它的负极材料是Zn,正极材料是G的一种常见氧化物,电解质是KOH。该电池的正极反应式为______________。
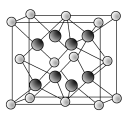
(6)由上述元素中电负性最大的元素和第一电离能最小的元素形成的某化合物N的晶胞如右图所示。化合物N与氧化钙相比,晶格能较小的是______(填化学式)。已知该化合物的晶胞边长为a pm,则该化合物的密度为________g·cm-3(只要求列出算式,不必计算出数值,阿伏加德罗常数的数值为NA,1 pm=10-10cm)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积,浓度均为0.1 mol·L-1的三种溶液:①CH3COOH溶液、②HSCN溶液、③NaHCO3溶液,已知将①、②分别与③混合,实验测得产生的CO2气体体积(V)随时间(t)变化的示意图如图所示,下列说法正确的是( )

A.物质酸性的比较:CH3COOH>HSCN>H2CO3
B.反应结束后所得两溶液中,c(CH3COO-)>c(SCN-)
C.上述三种溶液中由水电离的c(OH-)大小:NaHCO3>CH3COOH>HSCN
D.CH3COOH溶液和NaHCO3溶液反应所得溶液中:c(CH3COO-)+c(CH3COOH)=0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是( )
A. 碳酸氢钠可用于治疗胃酸过多的药物
B. 明矾溶于水形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
C. 二氧化硫有漂白性,可以用来漂白食物
D. 常温下,用铁、铝制容器来盛装浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列做法不应该提倡的是( )
A. 用布袋到超市购物 B. 将废电池深埋到泥土里
C. 积极推广氢能等新能源的使用 D. 对生活垃圾进行分类放置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Al加入到氯化铁与硫酸铜的混合溶液中,下列不可能出现的阳离子组合
A. Al3+、Fe2+、Fe3+、Cu2+ B. Al3+、Fe2+、Cu2+
C. Al3+、Cu2+ D. Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入150 mL 4 mol·L-1的稀硝酸,恰好使混合物完全溶解,放出2.24 L NO(标准状况),往所得溶液中加入KSCN溶液,溶液不呈红色。若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为( )
A.0.21 mol B.0.25 mol
C.0.3 mol D.0.35 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室制备气体和验证气体性质的装置图,若利用该装置实现碳和浓硫酸的反应,并进行如下验证:
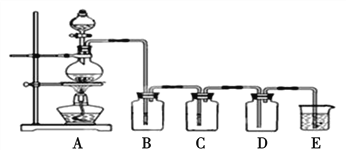
(1)实验步骤: 连接仪器、____、加药品后,然后滴入浓硫酸,加热。
(2)C与浓硫酸反应的化学方程式是____。
(3)若要证明产物中的两种气体,装置B、C、D、E中分别装有品红溶液、酸性KMnO4溶液、品红溶液、澄清石灰水,则B、D装置中品红溶液的作用分别是____,____。证明气体中有CO2的现象是____。
(4)若证明SO2具有氧化性,同时证明碳的非金属性比硅强,B、C、D中分别装有Na2S溶液、足量酸性KMnO4溶液、品红溶液。则:B中的现象为____;E中应加入____溶液(填化学式),现象为____,反应的离子方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对化学平衡移动的分析中,不正确的是( )
①已达平衡的反应C(s)+H2O(g)![]() CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g)![]() 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定增大
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定增大
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A. ①④ B. ①②③
C. ②③④ D. ①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com