
【题目】氢能作为一种清洁高效的二次能源,在未来能源格局中发挥着重要作用。已知:常温下,![]()
![]()
![]() ,
,![]() 。回答下列问题:
。回答下列问题:
(1)常温下、水的分解不能自发进行的热力学依据是________________________。
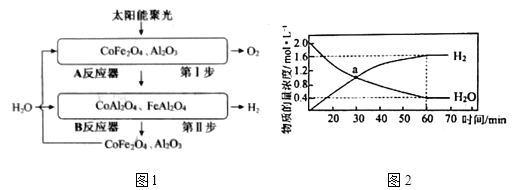
(2)将![]() 负载在
负载在![]() 上,产氧温度在1200℃,产氢温度在1000℃时,可顺利实现水的分解,氢气产量高且没有明显的烧结现象。循环机理如下,过程如图1所示,不考虑温度变化对反应
上,产氧温度在1200℃,产氢温度在1000℃时,可顺利实现水的分解,氢气产量高且没有明显的烧结现象。循环机理如下,过程如图1所示,不考虑温度变化对反应![]() 的影响。
的影响。
第Ⅰ步:![]()
![]()
![]()
第Ⅱ步:![]()
![]()
![]()
①![]() _________285.84(填“>”“<”或“=”)。第Ⅰ步反应中化合价有变化的元素为________(填名称)。
_________285.84(填“>”“<”或“=”)。第Ⅰ步反应中化合价有变化的元素为________(填名称)。
②第Ⅱ步反应的![]() ,
,![]() ,
,![]() 、
、![]() 分别为正、逆反应速率常数,仅与温度有关。1000℃时,在体积为1L的B反应器中加入2mol
分别为正、逆反应速率常数,仅与温度有关。1000℃时,在体积为1L的B反应器中加入2mol![]() 发生上述反应,测得
发生上述反应,测得![]() 和
和![]() 物质的量浓度随时间的变化如图2所示,则60min内,
物质的量浓度随时间的变化如图2所示,则60min内,![]() _________
_________![]() (保留2位小数)。a点时
(保留2位小数)。a点时![]() ________(填最简整数比);平衡时,体系压强为10kPa,则
________(填最简整数比);平衡时,体系压强为10kPa,则![]() _________。
_________。
(3)热力学铜-氯循环制氢法分电解、水解、热解三步进行。
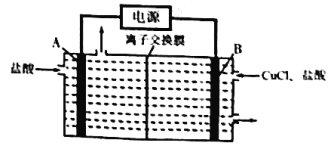
电解:![]() ;
;
水解:![]() ;
;
热解:![]() 。
。
已知:![]() 为白色固体,
为白色固体,![]() 。
。
电解装置如图所示,则A为________极(填“阳”或“阴”),B极电极反应为______________。
【答案】反应的![]() ,所以不能自发进行 < 铁、氧 6.27
,所以不能自发进行 < 铁、氧 6.27 ![]() 4 阴
4 阴 ![]()
【解析】
(1)根据题干信息得,常温下,水的分解反应中,因为![]() >0,反应不能自发进行,故答案为:反应的
>0,反应不能自发进行,故答案为:反应的![]() ,所以不能自发进行;
,所以不能自发进行;
(2)①第Ⅰ步反应与第Ⅱ反应相加可得反应![]() ,由于H2O(g)
,由于H2O(g)![]() H2O(l)反应放热,因此a+b<285.84,第Ⅰ步反应中,Fe元素的化合价由+6价降低至+2价,O元素的化合价由-2价升高至0价,故答案为:<;铁、氧;
H2O(l)反应放热,因此a+b<285.84,第Ⅰ步反应中,Fe元素的化合价由+6价降低至+2价,O元素的化合价由-2价升高至0价,故答案为:<;铁、氧;
②根据图2分析可知,反应进行到60min达到平衡,、‘60min内,H2的物质量浓度的变化量为1.6mol·L-1,列三段式有

则![]() ,当反应达到平衡状态时,v正=v逆,即k正·c(H2O)=k逆·c(H2),
,当反应达到平衡状态时,v正=v逆,即k正·c(H2O)=k逆·c(H2),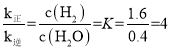 ,a点时,c(H2)=c(H2O),则v正:v逆=k正:k逆=4:1,平衡时,体系压强为10kPa,根据阿伏伽德罗定律PV=nRT可知,p(H2)=
,a点时,c(H2)=c(H2O),则v正:v逆=k正:k逆=4:1,平衡时,体系压强为10kPa,根据阿伏伽德罗定律PV=nRT可知,p(H2)=![]() ,p(H2O)=
,p(H2O)=![]() ,则
,则![]() ,故答案为:6.27;4:1;4;
,故答案为:6.27;4:1;4;
(3)有电解装置图可知,A极盐酸参与反应,H+得到电子,发生还原反应作阴极,电极反应为2H++2e-===H2↑,B极CuCl失去电子,发生氧化反应作阳极,电极反应为CuCl-e-===Cu2++Cl-,故答案为:阴;CuCl-e-===Cu2++Cl-。


科目:高中化学 来源: 题型:
【题目】Ⅰ.某化学课外活动小组欲检验茶叶中铁元素,设计了如下实验方案:

请回答:
(1)操作①的名称是_____。
(2)加入6mol·L-1的盐酸时为了加快铁元素的浸出速度,可采取的方法有____、_____。
(3)通过血红色溶液不能说明茶叶中的铁元素一定是+3价的,原因是______。
Ⅱ.乙酸乙酯广泛用于药物、染料、香料等工业,甲乙两同学分别设计了如下装置来制备乙酸乙酯,已知:乙酸乙酯的沸点为77.1℃,CH3CH2OH![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O

(1)甲装置中右边导管未插入溶液中的目的是 ______。
(2)实验结束后分离出乙酸乙酯的操作是 ____,必须用到的玻璃仪器有____(选择)。
A.烧杯 B.容量瓶 C.分液漏斗 D.蒸馏烧瓶
(3)乙装置优于甲装置的理由____________(写两条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,冰醋酸加水稀释过程中溶液的导电能力实验结果如图所示:
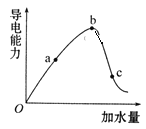
(1)“O”点为什么不导电?____________。
(2)比较a、b、c三点的c(H+)大小。____________(用“﹥”“=” 或“﹤”)
(3)a、b、c三点中,醋酸的电离程度最大的是哪一点?____________。
(4)若要使c点溶液中的c(CH3COO-)增大,试列举两条可行的措施______。
(5)在稀释过程中,c(H+)、n(H+)、c(OH-)和n(CH3COOH)中,始终保持增大趋势的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2O![]() H++OH- ΔH>0,下列叙述正确的是( )
H++OH- ΔH>0,下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量CH3COOH,平衡逆向移动,c(H+)降低
D.向水中加入少量固体醋酸钠,水的电离程度增大,Kw增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:

①下列说法正确的是__________。
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少 D.两烧杯中溶液的 pH 均增大
②在相同时间内, 两烧杯中产生气泡的速度: 甲__________乙(填“>”、 “<”或“=”)。
③请写出图中构成原电池的负极电极反应式: ____________。
④当甲中溶液质量增重 31.5 克时,电极上转移电子数目为______。
(2)图丙为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是 KOH。通甲烷一极的电极反应方程式为 ______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国是钢铁生产大国,也是铁矿石消费大国。某铁矿石主要成分为![]() 和
和![]() ,实验室为测定
,实验室为测定![]() 和
和![]() 的物质的量比,利用下图所示装置进行实验。
的物质的量比,利用下图所示装置进行实验。
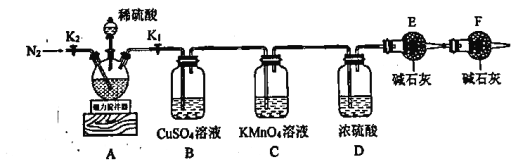
实验步骤如下:
Ⅰ.按图示连接仪器,检查装置气密性后加入药品;
Ⅱ.打开![]() 、
、![]() ,通入一段时间氮气,关闭
,通入一段时间氮气,关闭![]() 、
、![]() ,取下干燥管称量其质量(
,取下干燥管称量其质量(![]() )后再连接好装置;
)后再连接好装置;
Ⅲ.打开![]() 和分液漏斗活塞,向三颈烧瓶中慢慢滴加足量已经除去
和分液漏斗活塞,向三颈烧瓶中慢慢滴加足量已经除去![]() 的稀硫酸(其它杂质与稀硫酸不反应,且无还原性物质),待反应完成后,打开
的稀硫酸(其它杂质与稀硫酸不反应,且无还原性物质),待反应完成后,打开![]() 通入一段时间氮气;
通入一段时间氮气;
Ⅳ.关闭![]() 、
、![]() ,取下三颈烧瓶过滤、洗涤,将滤液与洗涤液合并成100mL溶液备用;
,取下三颈烧瓶过滤、洗涤,将滤液与洗涤液合并成100mL溶液备用;
Ⅴ.取下上述步骤ⅱ中的干燥管并称量其质量(![]() );
);
Ⅵ.取配制好的滤液25mL于锥形瓶中,用![]() 溶液滴定。
溶液滴定。
回答下列问题:
(1)步骤Ⅱ中需要称重的干燥管是_________(填“E”或“F”)。
(2)实验过程中发现B中有黑色沉淀生成,写出装置A中![]() 与稀硫酸反应的化学方程式__________________。
与稀硫酸反应的化学方程式__________________。
(3)C装置的作用是_________;若撤去装置F,则测得的![]() 的含量会_________(填“偏大”“偏小”或“无影响”)。
的含量会_________(填“偏大”“偏小”或“无影响”)。
(4)下列关于步骤Ⅳ的叙述正确的是_________(填标号)。
A.滤渣中含有还原产物单质硫
B.过滤过程中玻璃棒起到引流和搅拌的作用
C.过滤操作要迅速,否则会使测得的![]() 的含量偏低
的含量偏低
D.检验沉淀是否洗涤干净,可向滤液中加入氯化钡溶液,观察是否有白色沉淀生成
(5)步骤Ⅵ中发生反应的离子方程式为_________,到达滴定终点的现象是_________。
(6)若上述实验中![]() ,步骤Ⅵ消耗
,步骤Ⅵ消耗![]() 溶液45mL,则该矿石样品中
溶液45mL,则该矿石样品中![]() _________。
_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是( )

A. a和b都属于芳香族化合物
B. a和c分子中所有碳原子均处于同一平面上
C. a、b和c均能使酸性KMnO4溶液褪色
D. b和c均能与新制的Cu(OH)2反应生成红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等物质的量的N2、O2、CO2混合气体通过一定量Na2O2后,体积变为原体积的8/9(同温同压),这时混合气体中N2、O2、CO2物质的量之比为( )
A. 6: 7: 3 B. 3: 3: 2
C. 3: 4: 1 D. 6: 9: 0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】120℃、101.3 kPa,甲烷(CH4)和过量的O2的混合物,用电火花引燃(CH4+2O2=CO2+2H2O)后,恢复到原来的温度和压强,测得反应后气体密度为相同条件下H2密度的15倍,则原混合气体中甲烷和氧气的体积比为( )
A. 2∶1B. 1∶2C. 1∶7D. 7∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com