
【题目】4种相邻的主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性。回答下列问题:
m | n | ||
x | y |
(1)元素x在周期表中的位置是第_____周期、第____族,其单质可采用电解熔融的_____方法制备。
(2)m、n、y三种元素最高价氧化物的水化物中,酸性最强的是______,碱性最强的是______.(填化学式)
(3)气体分子(mn)2的电子式为_______,(mn)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是_____________________________。
【答案】(1) 第三周期第ⅡA族;MgCl2;(2) HNO3、Al(OH)3;
(3)![]() (CN)2+2NaOH=NaCN+NaCNO+H2O.
(CN)2+2NaOH=NaCN+NaCNO+H2O.
【解析】
根据题意可得x是Mg;y是Al;m是C;n是N。
(1)元素Mg在周期表中的位置是第三周期第ⅡA族,Mg在工业上采用电解熔融的MgCl2的方法制取;
(2)元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强,所以酸性强弱顺序是HNO3> H2CO3>Al(OH)3. 酸性最强的是HNO3。氢氧化铝是两性氢氧化物,既有酸性,也有碱性,因此碱性最强的是Al(OH)3;
(3)气体分子(CN)2是共价化合物。它的电子式为![]() ; (CN)2与NaOH反应类似氯气与氢氧化钠的反应。方程式是:(CN)2+2NaOH=NaCN+NaCNO+H2O。
; (CN)2与NaOH反应类似氯气与氢氧化钠的反应。方程式是:(CN)2+2NaOH=NaCN+NaCNO+H2O。


科目:高中化学 来源: 题型:
【题目】可逆反应2A(g)+B(g)![]() 2C(g)+2D(g) 在4种不同情况下反应速率分别如下,其中反应速率v最大的是
2C(g)+2D(g) 在4种不同情况下反应速率分别如下,其中反应速率v最大的是
A. v(A)=0.15mol·(L·min) -1B. v (B)=0.2 mol·(L·min) -1
C. v (C)=0.3 mol·(L·min) -1D. v (D)=0.1 mol·(L·min) -1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.2 mol·L-1的CH3COOH溶液中,当CH3COOH![]() H++CH3COO-已达平衡时,若要使CH3COOH的电离程度减小,溶液中的c(H+)增大,应加入( )
H++CH3COO-已达平衡时,若要使CH3COOH的电离程度减小,溶液中的c(H+)增大,应加入( )
A.CH3COONa固体B.氨水C.HClD.H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示。已知Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是( )
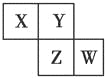
A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:Z>W>X
C. 氢化物的稳定性:X>Y>Z
D. 四种元素的单质中,Z单质的熔、沸点最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有A、B、C、D、E五种短周期的主族元素,它们的原子序数依次递增,A是所有元素中原子半径最小的元素,B、C组成的某一种化合物能引起温室效应.常温下,金属D单质投入水中能与水剧烈反应.常温下E单质是常见的气体.请按要求回答下列几个问题:
(1)B、D的元素名称分别为:_____、_____;
(2)E在周期表中的位置为:_____,
(3)C离子的结构示意图为:_____;
(4)B、C、D三种元素的原子半径从大到小的顺序为_____(用元素符号表示);
(5)B、E的最高价氧化物对应水化物的酸性从强到弱的顺序为:_____(用对应的化学式表示)
(6)写出C、D两种元素组成的阴、阳离子个数比为1:2且只含离子键的化合物的电子式:_____;
(7)写出E与水反应的离子方程式:_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg–AgCl电池是一种以海水为电解质溶液的水激活电池。如图用该水激活电池为电源电解NaCl溶液的实验中,X电极上有无色气体逸出。下列有关分析正确的是

A. II为正极,其反应式为Ag+ + e– =Ag
B. 水激活电池内Cl–由正极向负极迁移
C. 每转移1 mole-,U型管中消耗0. 5mol H2O
D. 开始时U型管中Y极附近pH逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在科学研究和工业生产中具有许多用途。请回答下列问题:
(1)画出基态Cu原子的价电子排布图__________________;
(2)已知高温下Cu2O比CuO稳定,从核外电子排布角度解释高温下Cu2O更稳定的原因_________________________________________________________________________。
(3)配合物[Cu(NH3)2]OOCCH3中碳原子的杂化类型是____________,配体中提供孤对电子的原子是____________。C、N、O三元素的第一电离能由大到小的顺序是__________(用元素符号表示)。
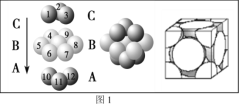
(4)铜晶体中铜原子的堆积方式如图1所示,则晶体铜原子的堆积方式为________________。
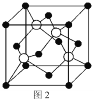
(5)M原子的价电子排布式为3s23p5,铜与M形成化合物的晶胞如图2所示(白球代表铜原子)。
①该晶体的化学式为_________________。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于_________化合物(填“离子”、“共价”)
③已知该晶体的密度为![]() g/cm3,阿伏加德罗常数的值为NA,则该晶体中Cu原子和M原子之间的最短距离为_________pm(写出计算式)。
g/cm3,阿伏加德罗常数的值为NA,则该晶体中Cu原子和M原子之间的最短距离为_________pm(写出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可用如图所示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)。请填空:
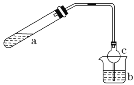
(1)试管a中需要加入浓硫酸、冰醋酸和乙醇各2 mL,正确的加入顺序及操作是______。
(2)为防止a中的液体在实验时发生暴沸,在加热前应采取的措施是_____________________。
(3)实验中加热试管a的目的是:
①_____________________________________________________;
②______________________________________________________。
a中反应的化学方程式:__________________________________。
(4)球形干燥管c的作用是_________________________________, b烧杯中加有饱和Na2CO3溶液,其作用是_____________________。
(5)若反应前向b中加入几滴酚酞,溶液呈红色,反应结束后b中的现象是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物.冶炼铜的反应为8CuFeS2+21O2![]() 8Cu+4FeO+2Fe2O3+16SO2.
8Cu+4FeO+2Fe2O3+16SO2.
(1)若CuFeS2中Fe的化合价为+2,反应中被还原的元素是__(填元素符号).
(2)用稀H2SO4浸泡上述反应制取铜后剩余的固体残渣,取少量所得溶液,检验溶液中存在Fe3+的方法是__(注明试剂、现象).
(3)上述冶炼过程产生大量SO2.下列处理方案中合理的是__(填代号)
a.高空排放 b.用于制备硫酸 c.用纯碱溶液吸收制Na2SO3 d.用浓硫酸吸收
(4)验证黄铜矿冶炼铜的反应后气体中含有SO2的方法是__.
(5)实验室制备,收集干燥的SO2,所需仪器如下.

①其中装置A产生SO2,反应的化学方程式为__.
②请按气流方向连接各仪器接口,顺序为a→__→ → → f,装置E中NaOH溶液的作用是__.E中反应的离子方程式__.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com