
【题目】X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。
回答下列问题:
(1) 元素M的核外电子排布式________ ;元素L的电子排布图为________ ;
(2)五种元素的原子半径从大到小的顺序是____________(用元素符号表示)。Y、Z、L的电离能由大到小的顺序是______________(用元素符号表示)
(3)Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的分子空间构型为__________,中心原子的杂化方式是________,A的电子式为____________,B的结构式为____________。
(4)NO3-的空间构型为__________;写出NO3-互为等电子体的一种分子的化学式_____________。
(5)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心,该化合物化学式为____,每个Ba2+与__个O2-配位。
【答案】 1s22s22p63s23p1 略 Al>C>N>O>H N>O>C 三角锥形 sp3杂化 ![]()
![]() 平面三角形 SO3或BF3 BaPbO3 12
平面三角形 SO3或BF3 BaPbO3 12
【解析】M是地壳中含量最高的金属元素,所以M是Al,X、Y、Z、L是组成蛋白质的基础元素,且X、Y、Z、L、M五种元素的原子序数依次增大,所以X、Y、Z、L分别是H、C、N、O。
(1) 元素M为Al,核外电子排布式为1s22s22p63s23p1;元素L为O,O原子核外有8个电子,分别位于1s、2s、2p轨道,1s、2s、2p轨道电子数分别是2、2、4,其核外电子排布图为![]() ,故答案为:1s22s22p63s23p1 ;
,故答案为:1s22s22p63s23p1 ;![]() ;
;
(2) 电子层越多半径越大,所以金属铝的半径最大,H的半径最小,同周期元素的原子从左到右半径逐渐减小,所以C>N>O,故原子半径大小顺序为:Al>C>N>O>H。一般而言,同一周期从左到右,第一电离能逐渐增大,但N的2p为半充满状态,较为稳定,第一电离能最大,Y、Z、L的电离能由大到小的顺序是N>O>C,故答案为:Al>C>N>O>H;N>O>C;
(3) N和H两元素按原子数目比l:3和2:4构成分子NH3和N2H4,均属由共价键构成的共价化合物,氨气的空间构型为三角锥形,N原子采用sp3杂化,电子式为:![]() ,N2H4的结构式为:
,N2H4的结构式为:![]() ,故答案为:三角锥形;sp3杂化;
,故答案为:三角锥形;sp3杂化;![]() ;
;![]() ;
;
(4) NO3-离子中氮原子的价电子对数为3+![]() ×(5+1-2×3)=3,所以NO3-离子的空间构型为平面三角形;NO3-离子中有四个原子,价电子数为24,所以与NO3-离子互为等电子体的一种分子为BF3、SO3、COCl2等,故答案为:平面正三角形;BF3、SO3、COCl2等;
×(5+1-2×3)=3,所以NO3-离子的空间构型为平面三角形;NO3-离子中有四个原子,价电子数为24,所以与NO3-离子互为等电子体的一种分子为BF3、SO3、COCl2等,故答案为:平面正三角形;BF3、SO3、COCl2等;
(5) Pb4+处于立方晶胞顶点,则晶胞中平均含有8×![]() =1个Pb4+,Ba2+处于晶胞中心,晶胞中含有1个Ba2+,O2-处于晶胞棱边中心,则晶胞含有O2-的个数为12×
=1个Pb4+,Ba2+处于晶胞中心,晶胞中含有1个Ba2+,O2-处于晶胞棱边中心,则晶胞含有O2-的个数为12×![]() =3,所以化学式为PbBaO3,Ba2+处于晶胞中心,O2-处于晶胞棱边中心,每个晶胞有12个棱,则每个Ba2+与12个O2-配位,故答案为:PbBaO3;12。
=3,所以化学式为PbBaO3,Ba2+处于晶胞中心,O2-处于晶胞棱边中心,每个晶胞有12个棱,则每个Ba2+与12个O2-配位,故答案为:PbBaO3;12。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。

(1)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择__________(填字母序号)
a.碳棒 b.锌板 c.铜板
用电化学原理解释材料B需定期拆换的原因_______________。

(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图2为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。
①E为该燃料电池的_____________极(填“正”或“负”)。F电极上的电极反应式为_____________。
②镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因____________。
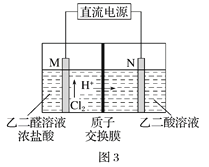
(3)乙醛酸(HOOC-CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图3所示,该装置中阴、阳两极为惰性电极,两级室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。
①N电极上的电极反应式为______________。
②若有2molH+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为________________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. HNO3是挥发性一元强酸
B. Al2O3既是金属氧化物,也是碱性氧化物
C. 氧气和臭氧的相互转化是物理变化
D. 利用过滤法可把Fe(OH)3胶体从FeCl3溶液中分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
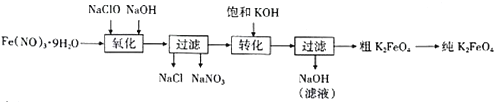
【题目】高铁酸钾(K2FeO4)是铁的一种重要化合物,是一种新型、高效、多功能水处理剂。一种湿法制备高铁酸钾的工艺流程如下图所示:
已知高铁酸钾的部分性质如下:
① 热稳定性差,溶液的pH对其稳定性的影响也很大;即在低温、碱性环境中稳定,高温、中性和酸性条件下不稳定。
② 在水中溶解度大,难溶于无水乙醇等有机溶剂。
③ 具有强氧化性,能氧化烃、80%以下的乙醇溶液等物质。
回答下列问题:
(1)该生产工艺应在温度_____(填“较高”或“较低”)的情况下进行。
(2)上述氧化过程中,发生反应的离了方程式为_______。
(3)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾
① 加入饱和KOH溶液的目的是:______。
② 由以上信息可知:Ksp(K2FeO4)______Ksp(Na2FeO4)(填“大于”或“小于”)。
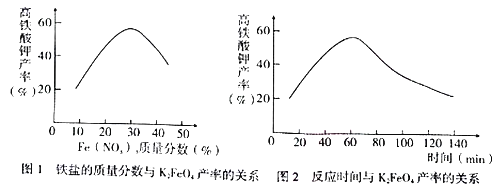
(4)实验测得铁盐溶液的质量分数、反应时间与K2FeO4产率的实验数据分别如下图l、图2所示。为了获取更多的高铁酸钾,铁盐的质量分数应控制在______附近、反应时间应控制在______。
(5)粗K2FeO4→纯K2FeO4包括重结晶、过滤、洗涤、干燥几个步骤。洗涤、干燥的目的是脱碱、脱水,洗涤时最好用______洗涤。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组利用下图装置进行碱式碳酸钴[Cox(OH)y(CO3)z]的化学组成测定的探究实验,图中铁架台等装置已略去,粗黑线表示乳胶管。

已知碱式碳酸钴受热时按右式分解:碱式碳酸钴![]() 钴的氧化物+CO2↑+H2O↑。
钴的氧化物+CO2↑+H2O↑。
回答下列问题:
(l)按如图所示装置组装好仪器,在装药品前,应先进行的操作是_______。
(2)称取3.65g样品置于硬质玻璃管内;打开活塞a,缓缓通入空气数分钟,关闭活塞a;加热硬质玻璃管,当丙装置中不再有气泡产生时,停止加热;又打开活塞a,再缓缓通入空气数分钟。两次通入空气的目的不同,第一次的目的是将装置中含二氧化碳和水蒸气的空气排尽,第二次的目的是______。
(3)通过正确实验测得丙、丁装置增重分别为0.36g、0.88g,则该碱式碳酸钴的化学式为______。
(4)甲装置中X试剂是______(填标号)。
a.浓硫酸 b.水氯化钙 c.五氧化二磷粉末 d.碱石灰
(5)若去掉戊装置,会使x的值______(填“偏大”“偏小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com