
【题目】实验室常用热的氢氧化钠溶液洗去试管内壁沾有的硫单质,发生反应6NaOH+3S![]() 2Na2S+Na2SO3+3H2O。关于该反应的说法不正确的是( )
2Na2S+Na2SO3+3H2O。关于该反应的说法不正确的是( )
A. 硫既是氧化剂又是还原剂 B. 硫化钠是还原产物
C. 硫既表现氧化性又表现还原性 D. 消耗3 mol 硫,转移电子6 mol
科目:高中化学 来源: 题型:
【题目】化学与科学、技术、社会、环境密切相关.下列有关说法中错误的是( )
A. 节日燃放的焰火是某些金属元素焰色反应所呈现出来的色彩
B. 为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶
C. 小苏打是制作馒头和面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂
D. 青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是钢铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答有关问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为 ________ ;
(2)表中能形成两性氢氧化物的元素是 ________ (用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式:_________;
(3)③⑦⑩三种元素的阴离子还原性顺序为: ___________________;⑦的水溶液呈__________色 ;
(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是 _______(填化学式) ;
(5)③元素与⑩元素两者核电荷数之差是 ____________ ;
(6)设计实验方案:比较⑦与⑥单质氧化性的强弱,请将方案填入下表。
实验步骤 | 实验现象与结论 |
____________________ | ____________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型可充电电池,能长时间保持稳定的放电电压。该电池的总反应式为
3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,以下说法不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,以下说法不正确的是
A. 放电时负极反应式为Zn+2OH--2e- = Zn(OH)2
B. 放电时正极反应式为 FeO42-+4H2O+3e-= Fe(OH)3+5OH-
C. 放电时每转移3 mol电子,正极有1mol K2FeO4被氧化
D. 充电时阳极附近溶液的碱性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 100mL12mol/L的浓硝酸与过量Cu反应转移电子数目为0.6NA
B. 将1molCl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA
C. 同温同压下,两个等体积的干燥圆底烧瓶中分别充满①HCl ②NO2 ,进行喷泉实验。经充分反应后烧瓶内溶质的物质的量浓度之比为3:2
D. 实验室里要用480 mL 0.1mol/L的硫酸铜溶液,需称取12.5克胆矾配制成溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂试剂的选择或除杂操作正确的是( )
选项 | 括号内为杂质 | 除杂试剂 | 除杂操作 |
A | CO2(SO2) | 饱和Na2CO3溶液 | 将气体通过足量的Na2CO3溶液 |
B | Na2O2(Na2O)固体 | O2 | 在纯氧气中加热 |
C | NO2(NO) | H2O | 将气体通入水中 |
D | NH3(H2O) | 浓硫酸 | 气体通入浓硫酸 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不可能通过一步反应直接完成的是
A. Al(OH)3 → Al2O3 B. Al2O3 → Al(OH)3
C. Al → AlO2- D. Al3+ → Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ亚铁氰化钾K4[Fe(CN)6],俗名黄血盐,可溶于水,不溶于乙醇。它是一种食品添加剂,我们所食用的部分食盐中就添加了亚铁氰化钾作为抗结剂。如果食用过量,易引起胃肠适。同学们可以观察一下家中食盐的配料表,尽量选用不含抗结剂的食盐。亚铁氰化钾可用如下方法进行制备。
已知HCN是一种极弱的酸,现有一种用含NaCN的废水合成黄血盐的主要工艺流程如下:
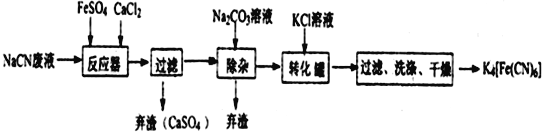
(1)常温下,NaCN水溶液的pH_______7(填“>”、“<”、“ = ”)。
(2)反应器中发生的主要反应的化学方程式为_____________________________。
(3)流程中加入Na2CO3溶液后过滤除去弃渣,过滤需要的玻璃仪器有烧杯、漏斗、______________。
(4)转化器中生成K4[Fe(CN)6]的反应类型是_______________,相同温度下,溶解度:K4[Fe(CN)6]___________Na4[Fe(CN)6](填“>”“ = ”“<”)。
(5)实验室常用K4[Fe(CN)6]检验Fe3+,生成难溶盐KFe[Fe(CN)6],试写出上述反应的离子方程式为_____________________________。
Ⅱ亚铁氰化钾也可以用硫酸亚铁铵为原料制备。可以用氧化还原滴定法测定晶体中Fe2+的含量。称取一份质量为20.0g 的硫酸亚铁铵晶体样品,制成溶液。用0.5 mol/L KMnO4溶液滴定,当溶液中Fe2+全部被氧化,MnO4- 被还原成Mn2+时,耗KMnO4 溶液体积20.00mL。
滴定时,将KMnO4 溶液装在____(酸式或碱式) 滴定管中,判断反应到达滴定终点的现象为__________ ;晶体中FeSO4的质量分数为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com