
����Ŀ�������仯���������ǵ�����ϢϢ��ء��ش��������⣺
I��(1)��֪����CO ��ȼ����H1����283 kJ��mol1
��N2(g)��O2(g)��2NO(g) H2����183 kJ��mol1
��д�� NO �� CO ��Ӧ��������Ⱦ��������Ȼ�ѧ��Ӧ����ʽ_________________��
��һ�������µ� NO �� CO �ķ�Ӧ�ﵽƽ�������߷�Ӧ����������� NO ת���ʵĴ�ʩ�� ______(�� ��ĸ���)��
a��ѹ����Ӧ����� b��ʹ�ø���Ч���� c�����߷���Ӧ�¶� d������CO��Ũ��
(2)һ�����������ݻ�Ϊ8L���ܱ������г���10molCO �� 8molNO������Ӧ���е� 20 min ʱ�ﵽƽ��״̬�����ƽ����ϵѹǿΪ 8 MPaNO �ĵ��������Ϊ25%����NO��ת���ʣ�________���� CO2 Ũ�ȱ仯��ʾ��ƽ����Ӧ���� v(CO2)��_______�����¶���ƽ�ⳣ�� Kp��______(��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ����ѹ�����ʵ���������������λ��Ч����)��
II���õ�ⷨ�ɳ�ȥ���Ṥҵ������β��NO�����õ� NH4NO3������ԭ������ͼ��

(1)N ��Ӧ���ӵ�Դ��______(��������������������)��M ���ĵ缫��ӦʽΪ________��
(2)������ͨ��NO��NH3 ��������ʵ���֮��Ϊ________��
���𰸡�2NO(g)+ 2CO (g) = 2CO2 (g)+N2 (g) ��H����749 kJ��mol1 a d 50% 0.025mol��L1��min1 0.11 �� 0.11MPa1 ���� NO+5e+6H+ =NH4++H2O 4:1
��������
I����1���ٸ��ݸ�˹���������Ӧ�ȣ�д���Ȼ�ѧ��Ӧ����ʽ��
�ڸ÷�ӦΪ���������С�ķ��ȷ�Ӧ������ѹǿ������CO��Ũ�ȶ��ܼӿ췴Ӧ���ʣ���ʹNO��ת��������
(2)����NO �ĵ�����������г�����ʽ�����ת������ƽ���������������������̼��Ũ�ȣ���CO2��Ũ�ȱ仯��ʾ��ƽ����Ӧ���ʣ����ƽ��ʱ��ѹ���ƽ���ѹ����ƽ��Ũ�ȵ�ƽ�ⳣ����
II����1��N����NOʧȥ����ת��Ϊ���������Ԫ�ػ��ϼ�������ʧȥ���ӣ�Ϊ������Ӧ���ӵ�Դ��������M����NOת��Ϊ笠���������ԭ��Ӧ��
��2�������ܷ�Ӧ����ʽΪ8NO��7H2O![]() 3NH4NO3��2HNO3�����ɵ�����ͷ�Ӧ��NO�����ʵ���֮�ȵ���2��8��1��4��ͨ���NH3�����ʵ�������Ӧ�����ɵ���������ʵ�����ȣ��ݴ˷�����
3NH4NO3��2HNO3�����ɵ�����ͷ�Ӧ��NO�����ʵ���֮�ȵ���2��8��1��4��ͨ���NH3�����ʵ�������Ӧ�����ɵ���������ʵ�����ȣ��ݴ˷�����
I����1������֪��CO��ȼ������H1����283 kJ��mol��1����
��2CO(g)+O2(g)![]() 2CO2(g)��H����566 kJ��moL��1
2CO2(g)��H����566 kJ��moL��1
��N2(g)��O2(g)��2NO(g)��H2����183kJ��mol-1��
���ݸ�˹���ɿ�֪�����ڼ��õ�NO��CO��Ӧ��������Ⱦ��������Ȼ�ѧ��Ӧ����ʽΪ2CO(g)+2NO(g)![]() N2(g)+2CO2(g)��H����749 kJ��moL��1��
N2(g)+2CO2(g)��H����749 kJ��moL��1��
��a��ѹ����Ӧ�������ѹǿ����Ӧ���ʼӿ죬ƽ��������Ӧ������У�ת��������a��ȷ��
b��ʹ�ø���Ч������Ӱ��ƽ�⣬b����
c�������¶�ƽ�����淴Ӧ������У�ת���ʽ��ͣ�c����
d������CO��Ũ����߷�Ӧ���ʵ�ͬʱ���NO��ת���ʣ�d��ȷ��
��ˣ�������ȷ��Ϊ��2NO(g)+ 2CO (g) = 2CO2 (g)+N2 (g) ��H����749 kJ��mol1 ��a d��
(2)����Ӧ���е�20 min�ﵽƽ��״̬�����������Ϊ8L��ƽ��ʱNO���������0.25������ݷ���ʽ��֪
2CO(g)+2NO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
��ʼ����mol�� 10 8 0 0
ת������mol�� 2x 2x x 2x
ƽ������mol�� 10��2x 8��2x x 2x
![]() =0.25�����x��2�����Դ�ʱNO��ת����Ϊ��
=0.25�����x��2�����Դ�ʱNO��ת����Ϊ��![]() ��100%=50%��
��100%=50%��
������̼Ũ��![]() =0.5mol/L��
=0.5mol/L��
�����CO2��Ũ�ȱ仯��ʾ��ƽ����Ӧ����v(CO2)��![]() =0.025mol��L1��min1��
=0.025mol��L1��min1��
���¶���ƽ�ⳣ��Kp��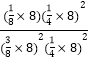 =0.11��
=0.11��
��ˣ�������ȷ��Ϊ��50% ��0.025mol��L1��min1��0.11 �� 0.11MPa1��
II����1��N����NOʧȥ����ת��Ϊ���������Ԫ�ػ��ϼ�������ʧȥ���ӣ�Ϊ������Ӧ���ӵ�Դ��������M����NOת��Ϊ笠����缫��ӦʽΪNO+5e+6H+ =NH4++H2O��
��ˣ�������ȷ��Ϊ��������NO+5e+6H+ =NH4++H2O��
��2���ܷ�Ӧ����ʽΪ8NO��7H2O![]() 3NH4NO3��2HNO3�����ɵ�����ͷ�Ӧ��NO�����ʵ���֮�ȵ���2��8��1��4��ͨ���NH3�����ʵ�������Ӧ�����ɵ���������ʵ�����ȣ����ͨ��NO��NH3 ��������ʵ���֮��Ϊ4:1��
3NH4NO3��2HNO3�����ɵ�����ͷ�Ӧ��NO�����ʵ���֮�ȵ���2��8��1��4��ͨ���NH3�����ʵ�������Ӧ�����ɵ���������ʵ�����ȣ����ͨ��NO��NH3 ��������ʵ���֮��Ϊ4:1��
��ˣ�������ȷ��Ϊ��4:1��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶�������㶨���ܱ������У������������ǿ��淴ӦA(��)+3B(��) ![]() 2C(��)+2D(��)�ﵽƽ��״̬�ı�־���ǣ�������
2C(��)+2D(��)�ﵽƽ��״̬�ı�־���ǣ�������
��C������������C�ķֽ��������
�ڵ�λʱ��������amolA,ͬʱ����3amolB
��A��B��C��Ũ�Ȳ��ٱ仯
�ܷ�Ӧ���ת���ʲ��ٱ仯
�ݻ�������ѹǿ���ٱ仯
�����������ʵ������ٱ仯
���������ܶȲ��ٱ仯
��A��B��C��D�ķ�����֮��Ϊ1:3:2:2
A. �ڢ� B. �ڢݢ� C. �٢ۢܢ� D. �ڢݢޢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϸ�������б������������й��ɣ��ж������ڵ�15λ���ķ���ʽ�ǣ�������
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | �� |
C2H2 | C2H4 | C2H6 | C3H4 | C3H6 | C3H8 | C4H6 | C4H8 | C4H10 |
A.C6H14B.C6H12C.C7H12D.C7H14
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶����������������Ϊ1.0L �ĺ����ܱ������з�����Ӧ 2CH3OH(g)![]() CH3OCH3( g)��H2O(g)
CH3OCH3( g)��H2O(g)
���� | �¶�(��) | ��ʼ���ʵ���(mmol) | ƽ�����ʵ��� (mol) | |
��� | ||||
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.10 | 0.040 | 0.040 |
�� | 387 | 0.20 | ||
�� | 207 | 0.20 | 0.090 | .090 |
������˵����ȷ����
A. �÷�Ӧ��H��0
B. �ﵽƽ��ʱ��CH3OH ��������������еı����� I �еĴ�
C. ��Ӧ�ﵽƽ������ʱ���������������
D. 207�� ����������( 1.0L �����ܱ�)���� CH3OH 0.1mol��CH3OCH3 0.15mol �� H2O0.20mol�� ��Ӧ��������Ӧ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Թ�ҵ������ɰ���÷�����þ��(��Ҫ�� MgO��SiO2��Fe2O3���������� FeO��CaO�� Al2O3 ��B2O3 ��)Ϊԭ����ȡ MgSO4��7H2O �Ĺ����������£�

�ش��������⣺
(1)�������õ��IJ��������в��������ձ���_______�����в�������������___________��
(2)���� 1 �е�ij������ �Dz�������Ҫ�ɷ�֮һ����������������Ҫ�ɷֵĻ�ѧʽΪ_____________�����ӹ��̼���MgO ��������__________________��
(3)д�����ӹ����д�����ƽ� Fe2+���������ӷ���ʽ__________________��
(4)���ӹ����У��� c(Al3+)=1��105 mol/L ʱ��c(Fe 3+)=__________mol/L��(��֪Ksp [Al(OH)3] = 3.2��1034 �� Ksp[Fe(OH)3]= 1.1��1036�����������λ��Ч���� )
(5)���� 3 ��Ҫ�ɷֵĻ�ѧʽ��___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����(����)
A. ���ڿ�����ȼ������Na2O
B. Na2CO3��NaHCO3�ȶ�,NaHCO3 ��Na2CO3������ˮ
C. �ò�˿պȡij��Һ������ɫ��Ӧ,����ʻ�ɫ,˵������Һ��һ������Na+,������K+
D. ��NaͶ��NH4Cl��Һ�п�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȡ��ͬ������ Ba(OH)2�� BaCO3��ɵľ��Ȼ����Ʒ,�ȼ�������ˮ�ܽ�,Ȼ�����100mLijŨ��ϡ����,����CO2�� ������(������Ϊ��״��)�������Ʒ��������ϵ��ͼ��ʾ(������CO2���ܽ⡢��Ӧ��̼�����ε�����)�������:

(1)�������Ba(OH)2�� BaCO3���ʵ���֮��Ϊ________��
(2)ϡ�������ʵ���Ũ��Ϊ________mo1/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. �춡���������黥Ϊͬϵ��
B. һ�ȼ����ڳ�����ΪҺ̬
C. ��������ά�ػ�Ϊͬ���칹��
D. ������Ӧ���ڼӳɷ�Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com