
在制玻璃的原料中,再加入下列物质后,可制得各种不同用途的玻璃:
| A.氧化亚铜(Cu2O) | B.氧化钴(Co2O3) |
| C.氧化铅(PbO) | D.硼砂(Na2B4O7·10H2O) |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
[化学——选修3:物质结构与性质](15分)
硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为____ ,该能层具有的原子轨道数为____ 、电子数为 。
(2)硅主要以硅酸盐、____ 等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以 相结合,其晶胞中共有8个原子,其中在面心位置贡献____ 个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4C1在液氨介质中反应制得SiH4,该反应的化学方程式为___ 。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是 。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是____ 。
(6)在硅酸盐中,SiO44-四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为 。Si与O的原子数之比为 。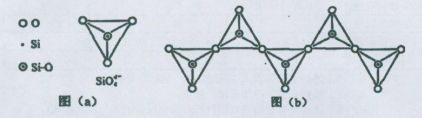
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如何除去下列各粉末状混合物中的杂质(括号内为杂质),请选用下面提供的试剂和操作,将标号填在表内。
供选试剂:A盐酸;B烧碱溶液;C氧气;D水;ECO2;F不用其他试剂
供选操作:①加热;②加热熔融;③过滤;④结晶
| 含杂质的物质 | 所加试剂 | 主要操作 |
| (1)SiO2(NaHCO3) | | |
| (2)SiO2(CaCO3) | | |
| (3)SiO2(Si) | | |
| (4)NaCl(SiO2) | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在化学课上围绕浓硫酸的化学性质进行了如下实验探究,将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀,然后加入浓硫酸,生成黑色物质。
请回答下列问题:
(1)生成的黑色物质(单质)是 (填化学式)。
(2)这种黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的主要污染物之一,这种刺激性气味的气体成分是 (填化学式),反应的化学方程式为 。
(3)据蔗糖与浓硫酸反应的实验现象,说明浓硫酸具有 (填序号)。
| A.酸性 | B.吸水性 | C.脱水性 | D.强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料——光导纤维,C与烧碱反应生成含A元素的化合物D。
(1)在元素周期表中,A位于 族,与A同族但相对原子质量比A小的元素B的原子结构示意图为 ,A与B在原子的电子层结构上的相同点是 。
(2)易与C发生化学反应的酸是 ,反应的化学方程式是 。
(3)将C与纯碱混合高温熔融时也发生化学反应生成D,同时还生成B的最高价氧化物E;将全部的E与全部的D在足量的水中混合后,又发生化学反应生成含A的化合物F。
①写出生成D和F的化学反应方程式: 。
②要将纯碱高温熔化,下列坩埚中可选用的是 。
A.普通玻璃坩埚 B.石英玻璃坩埚
C.氧化铝坩锅 D.铁坩锅
(4)100 g C与石灰石的混合物充分反应后,生成的气体在标准状况下的体积为11.2 L,100 g混合物中石灰石的质量分数是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
浓硫酸在高中化学实验中有着很重要的作用
(1)①铜与浓硫酸反应实验时,发现试管底部有白色固体并夹杂有少量黑色固体。倒去试管中的浓硫酸,将剩余固体(含少量浓硫酸)倒入盛有少量水的烧杯中,发现所得溶液为蓝色,黑色固体未溶解。过滤、洗涤后,向黑色固体中加入过量浓硝酸,黑色固体溶解,溶液呈蓝色,所得溶液加BaCl2溶液后有白色沉淀生成。则黑色固体中含有________元素。
②实验室利用浓硫酸分别与氯化钠固体和碘化钾固体加热反应制取所需物质,分析这两个反应中浓硫酸作用的异同点:_________________________________ 。
(2)探究浓硫酸的吸水性。某同学把98%的硫酸10mL和63.3%的硫酸(用10mL 98%的硫酸与10mL水配成)约20mL分别放入两个相同的大表面皿中,根据室温环境下实验的数据绘成的曲线如图。由右图曲线你能得到的实验结论有哪些?(写两点)______、_______________。
(3)苯与浓硝酸、浓硫酸制硝基苯的实验中,三种原料混合的顺序是_____________;要得到纯净的硝基苯,需经过:水洗 → 5%NaOH溶液洗涤 → 水洗 → 无水CaCl2干燥→________(填写操作),得到纯硝基苯。
(4)探究浓硫酸在生成乙酸乙酯反应中的作用。
问题提出:浓硫酸存在条件下酯化反应是否进行得更快。
设计实验:____________________。实验现象:___________________ 。
(5)浓硫酸与蔗糖反应的演示实验装置修改如下:实验时在大试管中先放入2g细小颗粒的蔗糖,滴加2—3滴碳酸钠浓溶液,再加入1.5mL 98%的浓硫酸,迅速塞紧带干燥管的单孔橡皮塞。可以看到,蔗糖迅速变黑,体积急剧膨胀,形成多孔海绵状固体物质——“黑面包”。分析实验效果更加明显的原因:____________________________________________________ 。
(6)苯分子等芳香烃化合物里的氢原子被硫酸分子里的磺酸基(—SO3H)所取代的反应,称为磺化反应。浓硫酸有时也用SO3代替浓硫酸,其优点是____________________、__________________。(至少写出两点)
用浓硫酸吸收SO3可得发烟硫酸(H2SO4·SO3)。某化工厂用1.5m3 98.3%的浓硫酸(密度为1.84g/mL)吸收SO3形成发烟硫酸,再与水混合,可得到95%的硫酸(密度为1.79g/mL)________m3(保留2位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图中A~J分别代表相关反应的一种物质。已知A分解得到等物质的量的B、C、D,图中有部分生成物未标出。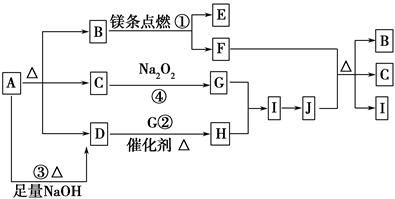
已知:2Mg+CO2 2MgO+C,请填写以下空白:
2MgO+C,请填写以下空白:
(1)A的化学式________。
(2)写出反应②的化学方程式:________________________________________。
(3)写出反应③的离子方程式:________________________________________。
(4)J与F反应的化学方程式:_________________________________________。
(5)在反应④中,当生成标准状况下2.24 L G时,转移电子数为________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)下列与含氯化合物有关的说法正确的是________(填字母)。
| A.HClO是弱酸,所以NaClO是弱电解质 |
| B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 |
| C.HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 |
| D.电解NaCl溶液得到22.4 L H2(标准状况),理论上需要转移NA个电子(NA表示阿伏加德罗常数) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
近年,为提高能利用率,西方提出共生理念——为提高经济效益,人类生产活动尽可能多功能化.共生工程将会大大促进化学工业的发展.
(1)由于共生工程的应用,利用发电厂产生的SO2制成自发电池,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V.实际过程中,将SO2通入电池的 极(填“正”或“负”),负极反应式为 .用这种方法处理SO2废气的优点是 .
(2)以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质.合成路线如下: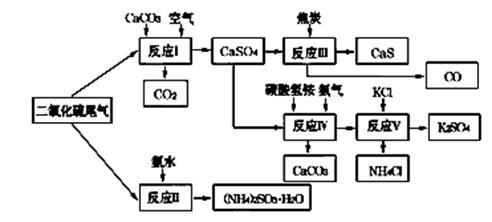
①生产中,向反应Ⅱ中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是 .
②下列有关说法正确的是 (填序号)。
| A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙 |
B.反应Ⅲ中发生反应的化学方程式为CaSO4+4C  CaS+4CO↑ CaS+4CO↑ |
| C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解 |
| D.反应Ⅴ中的副产物氯化铵可用作氮肥 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com