
分析 一定条件下存在反应:CO(g)+H2O(g)?CO2(g)+H2(g),其正反应放热,现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1mol CO和1mol H2O,在Ⅱ中充入1mol CO2 和1mol H2,
CO(g)+H2O(g)?CO2(g)+H2(g),
容器Ⅰ1mol 1mol 0 0
容器Ⅱ0 0 1mol 1mol
容器Ⅲ2mol 2mol 0 0
容器Ⅱ中所到达的平衡状态,相当于在容器Ⅰ中平衡的基础上降低温度.
解答 解:一定条件下存在反应:CO(g)+H2O(g)?CO2(g)+H2(g),其正反应放热,现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1mol CO和1mol H2O,在Ⅱ中充入1mol CO2 和1mol H2,
CO(g)+H2O(g)?CO2(g)+H2(g),
容器Ⅰ1mol 1mol 0 0
容器Ⅱ0 0 1mol 1mol
容器Ⅲ2mol 2mol 0 0
恒容绝热容器中,容器Ⅱ中是逆向进行所到达的平衡状态,相当于在容器Ⅰ中平衡的基础上降低温度,正反应为放热反应,所以降低温度平衡向正反应移动,平衡常数变大,K1<K2,
故答案为:<.
点评 本题考查了化学平衡常数的计算,注意从正逆反应方向达到平衡状态时,反应的热量变化不同,恒容绝热容器与外界没有热量交换,题目难度中等.


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:解答题
 一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图,依图所示:
一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图,依图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | Al片与少量NaOH溶液反应,产生气体:2Al+2OH-+2H2O═2Al(OH)3+3H2↑ | |
| C. | 向碳酸氢铵溶液中加过量石灰水并加热:NH4++OH-═NH3•H2O | |
| D. | 用酸化的高锰酸钾溶液氧化双氧水:2MnO4-+6H++5H2O═2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ③④⑤ | C. | ③④ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a2<a3<a1<a4 | B. | a3=a2<a1<a4 | C. | a2=a3<a4<a1 | D. | a1<a2<a3<a4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
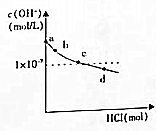
| 坐标对应点 | a | b | c | d |
| n(SO32-)n:(HSO3-) | 91:9 | 1:1 | 9:91 | |
| pH | >8.2 | 8.2 | 7.2 | 6.2 |
| A. | b点溶液中:水电离出的c(OH-)=1×10-5.8mol/L | |
| B. | c点溶液中:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+) | |
| C. | d点溶液中HSO3-的电离大于水解 | |
| D. | d点溶液中:c(Na+)<c(SO32-)+c(HSO3-)+c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
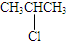 ③
③ ④
④ .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com