
【题目】常温下向某浓度的氯水中逐滴滴入Na2SO3溶液,无气体逸出,溶液pH变化如图所示,下列关系正确的是
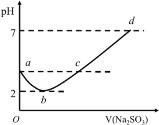
A.a点:c(H+)>c(Cl-)>c(ClO-)
B.b点:c(Cl-)=c(SO42-)=0.005mol·L-1
C.c点:c(Na+)=2c(HSO3-)+2c(SO32-)+2c(SO42-)
D.d点:c(Na+)=c(Cl-)+2c(SO32-)+2c(SO42-)
【答案】A
【解析】
A.a点为氯水,氯气和水反应生成HCl和HClO,HCl完全电离、HClO部分电离,则离子浓度大小为:c(H+)>c(Cl-)>c(HClO)>c(ClO-),故A正确;
B.b点是滴入亚硫酸钠和氯水中氯气恰好反应生成硫酸钠和盐酸:Na2SO3+Cl2+H2O=Na2SO4+2HCl,氯离子和硫酸根离子不水解,pH=2时氢离子浓度为0.01mol/L,则![]() c(Cl-)=c(SO42-)=0.005 molL-1,故B错误;
c(Cl-)=c(SO42-)=0.005 molL-1,故B错误;
C.c点含剩余少量HCl,生成氯化钠,溶质为氯化钠、亚硫酸、硫酸钠,溶液中还含有氯离子,则c(Na+)=2c(HSO3-)+2c(SO32-)+2c(SO42-)不成立,故C错误;
D.d点pH=7,则c(H+)=c(OH-),根据电荷守恒可知:c(Na+)=c(Cl-)+2c(SO32-)+c(HSO3-)+2c(SO42-),故D错误;
答案选A。


科目:高中化学 来源: 题型:
【题目】物质A、B、C、D、E、F、G、H、I、J、K存在下图转化关系,其中气体D、E为单质,试回答:
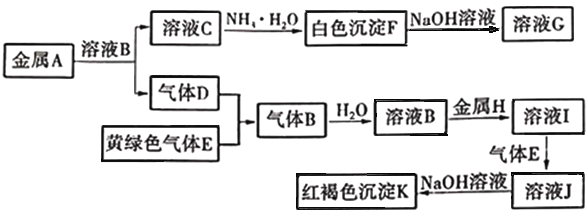
(1)写出下列物质的化学式:B是_________________, F是_________________,K是_________________。
(2)写出反应 “A→C”的离子方程式:_________________________________________。
(3)写出反应 “I→J”的化学方程式:_________________________________________。
(4)在溶液中滴加NaOH溶液,可观察到的现象是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两份体积相同的某植物营养液,其配方分别如下:
KCl | K2SO4 | ZnSO4 | |
① | 0.3 mol·L-1 | 0.2 mol·L-1 | 0.1 mol·L-1 |
② | 0.1 mol·L-1 | 0.3 mol·L-1 | — |
下列对这两份营养液成分的分析中正确的是( )
A. K+的物质的量相同
B. Cl-的物质的量相同
C. 完全相同
D. SO![]() 的物质的量不同
的物质的量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某一溴代烷与浓NaOH的醇溶液共热时产生3种沸点不同的消去产物,该一溴代烷至少应含有________个碳原子,其中一种结构简式可表示为____________。
Ⅱ.某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢。
(1)A的结构简式为________。
(2)A中的碳原子是否都处于同一平面?________(填“是”或者“不是”);
Ⅲ.有机物A分子式为C3H6O2,把它进行实验并记录现象如下:
NaOH溶液 | 银氨溶液 | 新制Cu(OH)2 | 金属钠 | |
A | 发生水解反应 | 有银镜反应 | 有红色沉淀 | 不反应 |
A的结构简式为:_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表是元素周期表的一部分,根据表中给出的10种元素,按要求作答。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | N | O | F | Ne | ||||
3 | Na | Mg | Al | Si | S | Cl |
(1)金属性最强的元素是_______;
(2)F的原子结构示意图是________;
(3)地壳中含量最多的元素是_______;
(4)Ne原子的最外层电子数是_______;
(5)N与O原子半径较大的是_______;
(6)H2S与HCl热稳定性较弱的是______;
(7)Na2O与MgO难与水反应的是______;
(8)Mg(OH)2与Al(OH)3能与强碱反应的是______;
(9)用于制造光导纤维的物质是______(填“Si”或“SiO2”);
(10)次氯酸(HClO)具有杀菌漂白作用,其中Cl元素的化合价为____,HClO不稳定,易分解生成HCl和O2,写出其在光照条件下分解的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光刻胶(I)是半导体制造的一种重要材料,其中一种合成路线如下,完成下列填空。
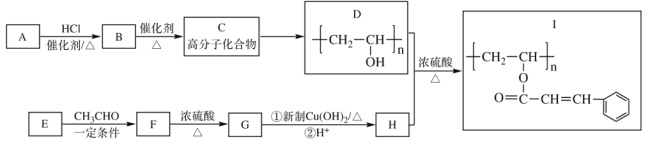
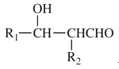
已知:![]()
(1)A的电子式_____________,E的结构简式_____________;
(2)C→D反应的试剂和条件为_____________,F→G的反应类型_____________;
(3)D+H→I的化学反应方程式___________________________________________;
(4)H的芳香类同分异构体中,可以发生水解反应和银镜反应的有_________种;
(5)![]() 是重要的工业加工助剂,写出以乙烯和乙醛为原料制备
是重要的工业加工助剂,写出以乙烯和乙醛为原料制备![]() 的合成路线。(其它无机试剂任选),(合成路线常用的表达方式为:A
的合成路线。(其它无机试剂任选),(合成路线常用的表达方式为:A B
B 目标产物)___________________
目标产物)___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活等密切相关,从化学视角回答下列问题:
(1)电闪雷鸣的雨天,空气中发生的化学反应会增加雨水的含氮量,有关反应的化学方程式是_____、_______、_________________。
(2)我国以煤炭为主的能源结构决定了我国的酸雨以硫酸型为主,为减少SO2的污染和酸雨的形成,目前常应用石灰法脱硫。过程如下:通过煅烧石灰石得到生石灰,以生石灰为脱硫剂,在吸收塔中与废气中的SO2反应而将硫固定,最终生成CaSO4,有关反应的化学方程式为_______、______、_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答下列问题。该小组设计的简单实验装置如图所示:

该实验的主要操作步骤如下:
①配制100mL1.0molL﹣1的盐酸溶液;
②用_______(填仪器名称并注明规格)量取10.0mL1.0molL﹣1的盐酸溶液加入锥形瓶中;
③称取ag已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为______;
④往广口瓶中装入足量水,按如图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为VmL。
请将上述步骤补充完整并回答下列问题:
(1)用文字表述实验步骤④中检查装置气密性的方法:______。
(2)实验步骤⑤中应选用______(填序号)的量筒。
A.100mL B.200mL C.500mL
读数时除恢复到室温外,还要注意______。
(3)若忽略水蒸气的影响,在实验条件下测得气体摩尔体积的计算式为Vm=______,若未除去镁条表面的氧化膜,则测量结果______(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA,则下列说法正确的是( )
A.常温常压下,11.2LCH4中含有的氢原子数等于2NA
B.标况下1molH2O的体积为22.4L
C.1mol Fe与足量盐酸充分反应失去电子数为3NA
D.1L 1mol·L-1K2CO3溶液中所含K+个数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com