
【题目】五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性。回答下列问题:
(1)由A和B、D、E所形成的共价型化合物中,沸点最高的是____(用化学式表示);
(2)A和E形成的化合物与A和B形成的化合物反应,产物的化学式为____,其中存在的化学键类型为_____;
(3)D最高价氧化物的水化物的化学式为____;
(4)单质D在充足的单质E中燃烧,反应的化学方程式为____;
(5)单质E与水反应的离子方程式为____。
【答案】NH3 NH4Cl 极性共价键和离子键 H3PO4 2P+5Cl2![]() 2PCl5 Cl2+H2O
2PCl5 Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
【解析】
根据题中“五种短周期元素A、B、C、D、E的原子序数依次增大,A和B形成的化合物在水中呈碱性”可知,A为H元素,B为N元素,由“A和C同族,B和D同族,C离子和B离子具有相同的电子层结构”可知C为Na,D为P,由“C和E形成的化合物在水中呈中性”可知E为Cl元素。据此进行判断。
(1)NH3、PH3和HCl这三个共价化合物中,NH3中存在分子间氢键,故其沸点最高,答案为:NH3;
(2)A和E形成的化合物是HCl,A和B形成的化合物是NH3,二者发生反应:HCl+NH3=NH4Cl,其中存在的化学键有:极性共价键和离子键。故答案为:NH4Cl;极性共价键和离子键。
(3)D为P元素,其最高价氧化物对应的水化物是:H3PO4;答案为:H3PO4;
(4)P在充足的Cl2中燃烧,发生反应:2P+5Cl2![]() 2PCl5,故答案为:2P+5Cl2
2PCl5,故答案为:2P+5Cl2![]() 2PCl5。
2PCl5。
(5)Cl2和水反应,反应方程式为:Cl2+H2O![]() HCl+HClO,离子反应方程式为:Cl2+H2O
HCl+HClO,离子反应方程式为:Cl2+H2O![]() H++Cl-+HClO。答案为:Cl2+H2O
H++Cl-+HClO。答案为:Cl2+H2O![]() H++Cl-+HClO。
H++Cl-+HClO。


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】已知反应![]() 为吸热反应,下列对该反应的说法正确的是( )
为吸热反应,下列对该反应的说法正确的是( )
A.X的能量一定低于M的能量,Y的能量一定低于![]() 的能量
的能量
B.因为该反应为吸热反应,故需要加热反应才能进行
C.破坏反应物中的化学键所吸收的能量大于形成生成物中化学键所放出的能量
D.反应物X和Y的总能量大于生成物M和N的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲探究CO还原CuO,设计如图所示装置(夹持装置略去)。下列说法正确的是
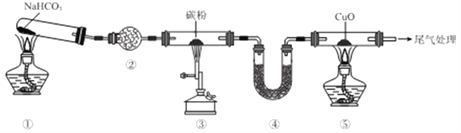
A. ②、④中均可盛装碱石灰
B. 加热的顺序为③、①、⑤
C. ①、③、⑤中均发生氧化还原反应
D. 可将尾气用导管通入到⑤的酒精灯处灼烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年6月6日,工信部正式向四大运营商颁发了5G商用牌照,揭示了我国5G元年的起点。通信用磷酸铁锂电池其有体积小、重量轻、高温性能突出、可高倍率充放电、绿色环保等众多优点。磷酸铁锂电池是以磷酸铁锂为正极材料的一种锂离子二次电池,放电时,正极反应式为M1-xFexPO4+e-+Li+=LiM1-x FexPO4,其原理如图所示,下列说法正确的是( )
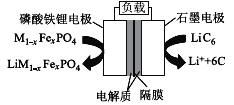
A.放电时,电流由石墨电极流向磷酸铁锂电极
B.电池总反应为M1-xFexPO4+LiC6![]() Li M1-xFexPO4+6C
Li M1-xFexPO4+6C
C.放电时,负极反应式为LiC6-e-=Li++6C
D.充电时,Li+移向磷酸铁锂电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近我国科学家在液流电池研究方面取得新进展。一种硫/碘体系(KI/K2S2)的液流电池工作原理如图所示。下列说法正确的是( )

A. 放电时电池右侧为负极,发生氧化反应
B. 放电时电池左侧的电极反应为S22-+2e-==2S2-
C. 充电时电解质溶液中K经交换膜向右侧移动
D. 充电时电池的总反应为3I-+S22-=I3-+2S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年3月,我国科学家研发出一种新型的锌碘单液流电池,其原理如图所示。下列说法不正确的是

A. 放电时B电极反应式为:I2+2e-=2I-
B. 放电时电解质储罐中离子总浓度增大
C. M为阳离子交换膜,N为阴离子交换膜
D. 充电时,A极增重65g时,C区增加离子数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图是碳和水蒸气发生反应生成CO、H2的途径和三个状态的能量,该反应为吸热反应,比较E1、E2、E3的大小:_____。

(2)已知2mol氢气燃烧生成液态水时放出572kJ的热量,反应方程式是2H2(g)+O2(g)═2H2O(l)。请回答下列问题:
①该反应的生成物能量总和____(填“大于”、“小于”或“等于”)反应物能量总和。
②若2mol氢气完全燃烧生成水蒸气,则放出的热量____(填“大于”、“小于”或“等于”)572kJ。
(3)已知拆开1molN﹣N键、1molN﹣H键、1molN≡N键、O=O键需要的能量分别是3akJ、2.5akJ、8akJ、4akJ,完全燃烧1mol火箭燃料肼(N2H4)生成氮气和水蒸气放出能量为5akJ,则1molH2O(g)完全断键时共吸收____kJ的能量。
(4)已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,反应物的总键能_____(填“大于”、“小于”或“等于”)生成物的总键能。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
(1)利用如图装置可验证同主族元素非金属性的变化规律:装置D的作用为_____。
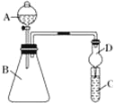
(2)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加_____(填KMnO4或MnO2),写出B中反应的离子方程式_____,C中加淀粉碘化钾混合溶液,观察到C中溶液____的现象,即可证明;
(3)若要证明非金属性:C>Si,则在A中加_____、B中加_____、C中加Na2SiO3溶液,观察到C中溶液出现白色沉淀的现象,即可证明。写出C中发生反应的离子方程式____,此装置有不足之处,应在两个装置中间添加有_____溶液的洗气瓶。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验探究小组研究320K时![]() 的分解反应:
的分解反应:![]() 。如图是该小组根据所给表格中的实验数据绘制的。下列有关说法正确的是( )
。如图是该小组根据所给表格中的实验数据绘制的。下列有关说法正确的是( )
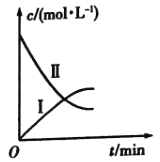
t/min | 0 | 1 | 2 | 3 | 4 |
| 0.160 | 0.114 | 0.080 | 0.056 | 0.040 |
| 0 | 0.023 | 0.040 | 0.052 | 0.060 |
A.曲线Ⅰ是![]() 的浓度变化曲线
的浓度变化曲线
B.曲线Ⅱ是![]() 的浓度变化曲线
的浓度变化曲线
C.![]() 的浓度越大,反应速率越快
的浓度越大,反应速率越快
D.![]() 的浓度越大,反应速率越快
的浓度越大,反应速率越快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com