
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
(1)利用如图装置可验证同主族元素非金属性的变化规律:装置D的作用为_____。
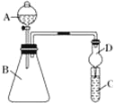
(2)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加_____(填KMnO4或MnO2),写出B中反应的离子方程式_____,C中加淀粉碘化钾混合溶液,观察到C中溶液____的现象,即可证明;
(3)若要证明非金属性:C>Si,则在A中加_____、B中加_____、C中加Na2SiO3溶液,观察到C中溶液出现白色沉淀的现象,即可证明。写出C中发生反应的离子方程式____,此装置有不足之处,应在两个装置中间添加有_____溶液的洗气瓶。
【答案】防倒吸 KMnO4 16H++10Cl-+2MnO4-=2Mn2++8H2O+5Cl2↑ 颜色变蓝色 盐酸 碳酸钙 SiO32-+CO2+H2O= H2SiO3↓+CO32- 饱和碳酸氢钠
【解析】
题给装置是一个可在常温下反应生成气体的气体制备验证装置,球形干燥管所起的作用是防倒吸。
由题给信息,可知此处判断元素的非金属性强弱依据的是:
(1)非金属性越强,元素所对应的单质的氧化性就越强,
(2)非金属性越强,则该元素的最高价氧化物对应的水化物的酸性就越强。
据此进行分析。
(1)仪器D为球形干燥管,可以防止倒吸。故答案为:防倒吸;
(2)要证明非金属性:Cl>I,左边装置应为制备Cl2的装置,根据反应条件,常温下进行,则应选择KMnO4,因为浓盐酸和MnO2反应制Cl2需加热;B中发生反应:16HCl+2KMnO4=2KCl+2MnCl2+8H2O+5Cl2↑,则离子反应方程式为:16H++10Cl-+2MnO4-=2Mn2++8H2O+5Cl2↑;Cl2通入C中,可以将KI中的I-氧化成I2,而淀粉遇I2变蓝,溶液颜色变化为蓝色,可证明非金属性Cl>I,故答案为:KMnO4;16H++10Cl-+2MnO4-=2Mn2++8H2O+5Cl2↑;颜色变蓝色;
(3)元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强,根据强酸能和弱酸盐反应制成弱酸,故可以在A中加盐酸,B中放碳酸钙,盐酸和碳酸钙反应生成二氧化碳和水,根据题意,C中放硅酸钠,反应后有白色沉淀产生,发生了反应:Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3,离子方程式为:SiO32-+CO2+H2O= H2SiO3↓+CO32-;因为反应中可能会因为盐酸的挥发性导致生成的CO2中混有HCl,盐酸也能和硅酸钠反应生成H2SiO3↓,对实验产生干扰,故可采用饱和碳酸氢钠溶液除去HCl,答案为:盐酸;碳酸钙;SiO32-+CO2+H2O= H2SiO3↓+CO32-;饱和碳酸氢钠。


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】室温下,向10 mL 0.1 mol/L醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中粒子的数目减小
B.再加入CH3COONa固体能促进醋酸的电离
C.醋酸的电离程度增大,c(H+)亦增大
D.溶液中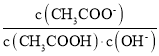 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性。回答下列问题:
(1)由A和B、D、E所形成的共价型化合物中,沸点最高的是____(用化学式表示);
(2)A和E形成的化合物与A和B形成的化合物反应,产物的化学式为____,其中存在的化学键类型为_____;
(3)D最高价氧化物的水化物的化学式为____;
(4)单质D在充足的单质E中燃烧,反应的化学方程式为____;
(5)单质E与水反应的离子方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】mA(g)+nB(g)![]() pC(g)的速率和平衡的影响图像如下,下列判断正确的是
pC(g)的速率和平衡的影响图像如下,下列判断正确的是

A.由图1可知,T1<T2,该反应正反应为吸热反应
B.由图2可知,该反应m+n﹤p
C.图3中,表示反应速率v正>v逆的是点3
D.图4中,若m+n=p,则a曲线一定使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温、恒压下,在一个容积可变的容器中发生如下反应:N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
(1)若开始时放入1 mol N2和3 mol H2,达到平衡后,生成a mol NH3,这时N2的物质的量为________mol
(2)若开始时无NH3,只放入N2和H2,达到平衡时生成NH3的物质的量为3a mol,则开始时放入H2的物质的量为________mol(平衡时NH3的质量分数与(1)中相同)。
(3)若开始时放入x mol N2、6 mol H2和2 mol NH3达到平衡后,N2和NH3的物质的量分别为y mol和3a mol,则y=________。平衡时H2的物质的量________(选填一个编号)。
A.大于6 mol B.等于6 mol C.小于6 mol D.可能大于、小于或等于6 mol
(4)若在(3)的平衡混合物中,再加入6 mol NH3,再次达到平衡后,NH3的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为(MgCO3,舍少量FeCO3)为原料制备高纯氧化镁的实验流程如下:

(1)加入H2O2氧化时,发生反应的化学方程式为___________________________。
(2)滤渣2的成分是_________(填化学式)。
煅烧过程存在以下反应:
2MgSO4+C![]() 2MgO+2SO2↑+CO2↑;MgSO4+C
2MgO+2SO2↑+CO2↑;MgSO4+C![]() MgO+SO2↑+CO↑;MgSO4+3C
MgO+SO2↑+CO↑;MgSO4+3C![]() MgO+S↑+3CO↑。
MgO+S↑+3CO↑。
利用下图装置对煅烧产生的气体进行分步吸收或收集。

(3)D中收集的气体是__________(填化学式)。
(4)B中盛放的溶液是_________(填序号)。
a.NaOH溶液 b.Na2CO3溶液 c.稀硝酸 d..KMnO4溶液
(5)A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施对增大反应速率有效的是( )
A.![]() 与稀硫酸反应制取H2时,改用浓硫酸
与稀硫酸反应制取H2时,改用浓硫酸
B.Na与水反应时,增大水的用量
C.在K2SO4溶液与BaCl2溶液反应时,增大压强
D.在密闭容器中进行反应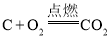 时,压缩容器体积,增大压强
时,压缩容器体积,增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1L定容的密闭容器中,可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是
2NH3已达到平衡状态的是
A. c(N2):c(H2):c(NH3)=1:3:2
B. 一个N≡N 断裂的同时,有3个H-H生成
C. 其他条件不变时,混合气体的密度不再改变
D. v正(N2)═2 v逆(NH3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学工业体现了化学科学的实际应用价值,下列化学工业过程,以生产盐类化合物为主要目标的是( )
A.侯氏制碱法B.煤的气化C.合成氨工业D.氯碱工业
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com