
| 0.006+0.012 |
| 0.6 |
| 0.00075mol+0.00025mol |
| 0.1L |
| KW |
| C(OH-) |
| 0.12mol/L×VL-0.1mol/L×VL |
| 2V |
| KW |
| C(OH-) |
| 1×10-14 |
| 0.01 |


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
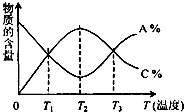 已知可逆反应aA+bBcC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是 (两个答案)( )
已知可逆反应aA+bBcC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是 (两个答案)( )| A、该反应在T1、T3温度时达到过化学平衡 |
| B、该反应在T2温度时达到过化学平衡 |
| C、该反应的逆反应是吸热反应 |
| D、升高温度,平衡会向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、溶液中c(NH3?H2O)?
| ||||
| B、NH3?H2O的电离程度增大,c(OH-)也增大 | ||||
| C、溶液中导电微粒数目减少 | ||||
| D、再加20mL pH=3的盐酸,混合溶液的pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中始终有:c(Na+)+c(H+)═2c(S2-)+c(HS-)+c(OH-) |
| B、t溶液呈中性时:c(Na+)═c(HS-)+c(S2-) |
| C、等体积混合后溶液中一定有:c(H2S)+c(H+)═c(S2-)+c(OH-) |
| D、恰好完全中和后的溶液中:c(Na+)>2c(S2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D |
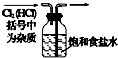 | 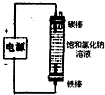 | 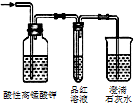 | 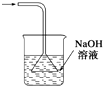 |
| 除去氯气中的杂质 | 制取84消毒液(NaClO) | 检验二氧化硫中是否混有二氧化碳 | 吸收氯化氢尾气 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 化学平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
A、该反应的化学平衡常数表达式为:K=
| ||
| B、该反应为吸热反应 | ||
| C、单位时间内生成B和D的物质的量相等时,该反应处于平衡状态 | ||
| D、其它条件不变时,增大体系的压强,化学平衡常数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
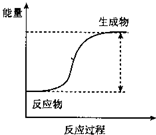 (1)反应的分类研究:从能量变化角度分,将反应分为放热反应和吸热反应.下列反应中能量变化符合如图所示的是
(1)反应的分类研究:从能量变化角度分,将反应分为放热反应和吸热反应.下列反应中能量变化符合如图所示的是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、通常情况下,1.5 mol O2的体积约为33.6 L |
| B、NaOH的摩尔质量是40 g |
| C、在100 mL水中溶解5.85 g NaCl,则所得NaCl溶液的物质的量浓度为1 mol?L-1 |
| D、同温同压下,相同体积的任何气体所含的分子数一定相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com