
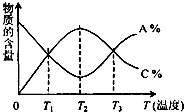
 已知可逆反应aA+bBcC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是 (两个答案)( )
已知可逆反应aA+bBcC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是 (两个答案)( )| A、该反应在T1、T3温度时达到过化学平衡 |
| B、该反应在T2温度时达到过化学平衡 |
| C、该反应的逆反应是吸热反应 |
| D、升高温度,平衡会向正反应方向移动 |


科目:高中化学 来源: 题型:
| A、C3H8(g)+5O2(g)→3CO2(g)+4H2O(g)△H═+2 217.8 kJ?mol-1 | ||
| B、C3H8(g)+5O2(g)→3CO2(g)+4H2O(g)△H═-2 217.8 kJ?mol-1 | ||
| C、C3H8(g)+5O2(g)→3CO2(g)+4H2O(l)△H═-2 217.8 kJ?mol-1 | ||
D、15C3H8(g)+O2(g)→
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑦ | B、②③⑥ |
| C、①④⑤ | D、①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 烯烃分子在一定条件下会发生二分子聚合,其实质是一个分子中饱和碳原子上的一个C-H键断裂,对另一个分子中的双键进行加成.也可以烯烃复分解反应.如:
烯烃分子在一定条件下会发生二分子聚合,其实质是一个分子中饱和碳原子上的一个C-H键断裂,对另一个分子中的双键进行加成.也可以烯烃复分解反应.如:
| 金属卡宾 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 13 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应混合物中各组分的浓度相等 |
| B、正逆反应都还在继续进行 |
| C、正逆反应的速率均为零 |
| D、化学平衡理论是研究怎样使原料尽可能多地转化为产品 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com