
【题目】我国科学家研制出一种催化剂,能在室温下高效催化空气中甲醛的氧化,其反应如下:HCHO+O2![]() CO2+H2O △H<0。下列有关说法正确的是( )
CO2+H2O △H<0。下列有关说法正确的是( )
A. 该反应为吸热反应
B. CO2分子中的化学键为非极性键
C. HCHO分子中既含σ键又含π键
D. 每生成1.8g H2O消耗2.24 L O2
 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】(1)很多含氯物质都能做消毒剂。液氯可以用于饮用水消毒,但是消毒后的水中可能产生危害人体健康的有机氧化物。世界各国陆续开发新型自来水消毒剂,下列物质可以用于自来水消毒的有___。
A.Na2O2 B.Cl2O2 C.O3 D.O2 E.ClO2
(2)Na2FeO4为紫色物质,也可以用于自来水消毒,高铁酸钠处理过的水中含有氢氧化铁胶体,用激光笔照射,可以从侧面看到一条光路,这个现象在化学上被成为___。
(3)漂白液是一种常用消毒剂,其中的有效成分是___(写出化学式)。
(4)漂白粉也是常见消毒剂。工业上使用漂白粉一般加入少量盐酸或醋酸,促使___(填写出物质名称)产生,以增强漂白杀菌作用。请用化学方程式表示家用漂白粉不加入酸如何产生该物质___。
(5)漂白粉的质量靠它的“有效氯”衡量。有效氯是根据它同盐酸作用时产生的氯气量来计算的。请配平完成该过程的化学方程式:__Ca(ClO)2+__HCl=__Cl2↑+__CaCl2+__。生成的微量氯气与氢碘酸反应,可以得到碘单质,反应生成的碘与Na2S2O3可以定量的进行反应:2Na2S2O3+I2=Na2S4O6+2NaI,漂白粉的有效氯=(漂白粉加酸所释放出的氯气的质量/漂白粉的质量)×100%。漂白粉的有效氯一般高于30%,某化工厂漂白粉2g进行上述一系列反应进行测定,消耗硫代硫酸钠0.02mol,则其有效氯为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验现象或要求写离子方程式(描述现象的,需要写出所有涉及的离子方程式。非特殊说明,书写离子方程式)
实验现象 | 离子方程式 |
1.向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解 | ______ |
2.制备氢氧化铁胶体的化学方程式 | ______ |
3.二氧化硫使酸性高锰酸钾溶液褪色 | ______ |
4.Fe3O4溶于稀硝酸 | ______ |
5.氯化亚铁溶液通入少量氯气,变为黄色溶液,加入过量碘化钾溶液,溶液颜色加深,继续加入NaOH溶液,出现白色沉淀,且颜色不断加深至红褐色。 | ______ |
6.澄清石灰水中通入CO2出现白色沉淀,继续通入二氧化碳,沉淀溶解,加热后又出现白色沉淀。 | ______ |
7.三氯化铝溶液中加逐滴加入NaOH溶液,先出现白色沉淀,然后溶解,再通入CO2至刚开始出现沉淀。 | ______ |
8.NH4Al(SO4)2溶液与Ba(OH)2溶液物质的量1∶2混合 | ______ |
9.FeI2与Cl2物质的量1∶2反应 | ______ |
10.Ba(OH)2中加入硫酸铝溶液,至沉淀质量不再改变。再加入过量NaHCO3溶液,又出白色沉淀。 | ______ |
11.生产硫化钠大多采用无水芒硝(Na2SO4)—碳粉还原法,若煅烧所得气体为等物质的量的CO和CO2,写出煅烧时发生反应的化学方程式 | ______ |
12.温度高于200 ℃时,硝酸铝完全分解成氧化铝和两种气体(其体积比为4∶1),写出该反应的化学方程式 | ______ |
13.湿法制备高铁酸钾(K2FeO4)的过程为,在氢氧化铁固体中加入KClO和KOH的混合液。写出该过程的离子方程式并配平。 | ______ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对甲基苯乙烯(![]() )是有机合成的重要原料。下列对其结构与性质的推错误的是( )
)是有机合成的重要原料。下列对其结构与性质的推错误的是( )
A. 分子式为![]()
B. 能发生加聚反应和氧化反应
C. 具有相同官能团的芳香烃同分异构体有5种![]() 不考虑立体异构
不考虑立体异构![]()
D. 分子中所有原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为长式周期表的一部分,其中的编号代表对应的元素。
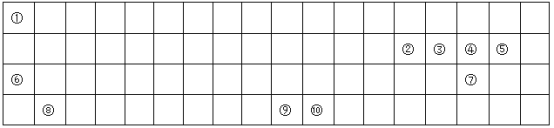
请回答下列问题:
(1)在表中画出元素周期表前四周期的边框______。
(2)表中属于d区的元素符号为________,其基态原子的价层电子排布图为__________。
(3)元素①与②形成的一种化合物是重要的化工原料,常把该物质的产量作为衡量石油化工发展水平的标志。有关该分子的说法正确的是_____ 。
A.分子间存在氢键 B.属于非极性分子
C.含有4个σ键和1个π键 D.该分子中,中心原子采用sp2杂化
(4)①、③、④、⑦、⑩五种元素形成的一种常见的深蓝色配合物, 其化学式为_____________
1摩尔配合离子所含σ键个数为__________,配体分子的空间构型为_______ ;与该配体分子互为等电子体的阳离子的符号为___________。
(5)③、④、⑥三种元素第二电离能从小到大依次为:___________(用元素符号填空)。
(6)元素⑩的焰色为绿色,很多金属元素能形成焰色反应的原因为_________________。
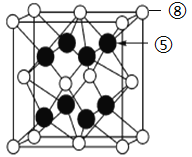
(7) ⑧与⑤形成离子化合物的晶胞结构如图所示。可以用____________方法区分晶体和非晶体。该晶胞中,⑧离子的配位数为_____________;若晶体的密度为ag·cm-3,阿伏加德罗常数的值为NA,则晶胞中最近的两个⑤离子间距离为_________________pm(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A.加入催化剂可以加快合成氨的速率
B.新制的氯水在光照条件下颜色变浅
C.实验室中常用排饱和食盐水的方法收集氯气
D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2X(g)+Y(g)![]() 2Z(g),反应中ω(Z的物质的量分数)随温度T的变化如下图所示。下列判断正确的是( )
2Z(g),反应中ω(Z的物质的量分数)随温度T的变化如下图所示。下列判断正确的是( )
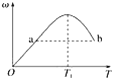
A. T1时,v正>v逆
B. 正反应的ΔH<0
C. a、b两点的反应速率v(a)=v(b)
D. 当温度低于T1时,ω增大的原因是平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生实验小组用50mL 1.0mol·L-1的盐酸与50mL 1.1mol·L-1的NaOH溶液在如图所示的装置中进行中和反应反应热的测定。
(1)图中装置缺少的一种仪器,该仪器名称为_________。
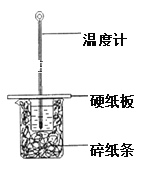
(2)如果改用60mL 1.Omol·L-1盐酸跟50mL 1.1mol·L—1氢氧化钠溶液进行反应,则与上述实验相比,所放热量____________(填“增加” “减少”或“不变”),所求中和热数值 ________ (填“增加”“减少”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在乙醇的化学性质中,各反应的断键方式可概括如图:
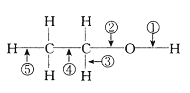
用序号填空:
(1)消去反应的断键位置是___________,化学方程式为________________。
(2)与金属Na反应的断键位置是___________,化学方程为________________。
(3)催化氧化的断键位置是________________,化学方程为_______________。
(4)分子间脱水的断键位置是___________,化学方程为________________。
(5)与HBr反应的断键位置是_______________,化学方程为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com