
����Ŀ��I������A�����ᣬB�����ᣬC�����������ᣬ�������������ź�����������������������ա�
��1����ͬ�����ͬpH���������У��ֱ����������NaHCO3��ĩ������ͬ�����²���CO2������ɴ�С��˳���� ��
��2�����ʵ���Ũ�Ⱦ�Ϊ0.1 mol/L����������Һ��pH�ɴ�С��˳���� �����ȡ�������0.1 mol/L����������Һ����0.1 mol/L��NaOH�кͣ���ǡ����ȫ��Ӧʱ������NaOH��Һ������ɴ�С��˳���� ��
II����ʵ��ȷ��ij��HB��������ʡ���ͬѧ�ķ����ǣ�
�ף�����ȡһ��������HB����0.1mol/L����Һ100mL��
����pH��ֽ�������Һ��pHֵ������֤��HB�����������
�ң�������֪���ʵ���Ũ�ȵ�HB��Һ���������ֱ�����pH = 1����������Һ��100mL��
���ֱ�ȡ��������Һ��10mL����ˮϡ��Ϊ100mL��
����ȡ��ͬ���������ϡ��Һװ�������Թܣ�ͬʱ���봿����ͬ��п�����۲�������֤��HB�����������
��1���������У�˵��HB����������������������Һ��pH 1��ѡ�����������
��2����������������������ʵ��֮���Ͳ���֮���� ��
III�����ᣨH3BO3����������������Ļ���ԭ�ϡ���֪H3BO3�ĵ��볣��Ϊ5.8��10��10��H2CO3�ĵ��볣��ΪK1=4.4��10��7��K2=4.7��10��11����ʢ�б���������Һ���Թ���,�μ�0.1 mol/LNa2CO3��Һ�� (��ܡ����ܡ����۲쵽�����ݳ���
��֪H3BO3������NaOH��Һ��Ӧ�����ӷ���ʽΪH3BO3+OH��=B(OH)4����д��������ˮ��Һ�еĵ��뷽��ʽ ��
���𰸡�I����1��a��b��c ����2��a��b��c ��c��b��a ��
II ����1��������2������pH��1����Һ����ʵ�֣������п�����������������ͬ ��
III�������� H3BO3��H2O![]() B(OH)4����H����
B(OH)4����H����
��������
���������I����������ᶼ��һԪ�ᣬ���������ᣬ������ǿ�ᣬ�����Ƕ�Ԫǿ�ᣬ���Դ����д��ڵ���ƽ�⣬�Ȼ����������ȫ���롣��1��ͬ�����ͬpH���������У�����������������ӵ����ʵ�����ȣ�������Һ�д�������ʵ����������ᣬ�ֱ����������̼���Ʒ�ĩ�������ӵ����ʵ���Խ�����ɵĶ�����̼���Խ����������������ɵĶ�����̼�����ͬ�����������ɵĶ�����̼��������������ͬ�����²���CO2������ɴ�С��˳����a��b=c����2��������Ũ��Խ����Һ��pHԽС�����ʵ���Ũ��Ϊ0.1molL-1����������Һ��������������Ũ�����������������Ũ�ȴ�֮��������������Ũ����С��������������Һ��pH�ɴ�С��˳����a��b��c������ʹ��ᶼ��һԪ�ᣬ�����Ƕ�Ԫ�ᣬ������������ʵ���Ũ�ȵ���������Ӧʱ�����ļ�����ʵ�����������ʵ�����Ԫ�������ȣ�����������������������࣬����ʹ��������������Ƶ�����ȣ��� c��a=b��II����1��������ˮ��Һ�ﲿ�ֵ��룬����������Ũ��С����Ũ�ȣ�������������ᣬ��0.1mol/L��HB��Һ��pH��1����2��HB��������ڵ���ƽ�⣬��������pH=1��HA��Һ����ʵ�֣���Ӧ��ĽӴ�����뷴Ӧ���ʳ����ȣ�п���ı������С���Կ��ƣ�����ʵ�ֽ����ѡ��ʴ�Ϊ������pH=1��HA��Һ����ʵ�֣�����п�����������������ͬ��III����1��H3BO3�ĵ��볣��Ϊ5.8��10-10 ��H2CO3�ĵ��볣��ΪK1=4.4��10-7����5.8��10-10��4.4��10-7�����Բ��ܹ۲쵽�����ݳ�����2�������������ǻ���������������ӣ�����ʽΪ��H3BO3��H2O![]() B(OH)4����H����
B(OH)4����H����


 ͬ����ϰǿ����չϵ�д�
ͬ����ϰǿ����չϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������漰��ѧ�仯����
A����������װʳƷ�Ŀ������� B������������ֽ����Ư��
C�����������ͨ�����Ŀ�ʴ�� D���л��ܼ���ʳ���͵���ȡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ʼ��仯�����ڹ�ũҵ������������Ҫ��Ӧ�á�
��1����֪25��ʱ��SO2��g����2CO��g����2CO2��g����1/x Sx��s�� ��H��akJ/mol
2COS��g����SO2��g����2CO2��g����3/x Sx��s�� ��H��bkJ/mol��
��COS��g������CO��g����Sx��s����Ӧ���Ȼ�ѧ����ʽ�� ��
��2���ƻ�(As2S3)����ȡ�����Ҫ����ԭ�ϡ���֪As2S3���Ժ�ŨHNO3��Ӧ��������0.6mol��H3AsO4ʱ����Ӧ��ת�Ƶ��ӵ���ĿΪ3NA����As2S3��ŨHNO3��Ӧ�ķ���ʽ��
��3��������ʵ���Ũ��Na2S��NaOH�����Һ�еμ�ϡ����������������H2S��HS��S2�ķֲ�������ƽ��ʱij���ֵ�Ũ��ռ������Ũ��֮�͵ķ�������μ���������Ĺ�ϵ����ͼ��ʾ�����Եμӹ���H2S������ݳ�����
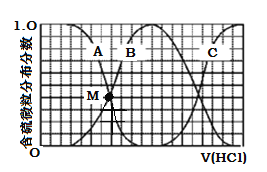
������B��ʾ �ķֲ�������
�ڵμӹ����У���Һ����Ũ�ȴ�С��ϵ��ȷ���� (����ĸ)��
A��c(Na+)= c(HS)+2c(S2)
B��3c(H2S)+2c(HS)+c(S2)+c(H+)=c(OH)
C��3c(Na+)=[c(H2S)+c(HS)+c(S2)]
��NaHS��Һ�ʼ��ԣ����μ�������M�㣨A��B���ߵĽ���㣩ʱ����Һ�и�����Ũ���ɴ�С��˳��Ϊ
��4����ҵ������·ѭ����������������Ĺ�����������ͼ��ʾ��
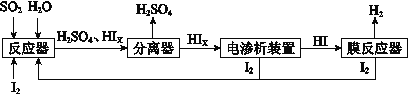
��д����Ӧ���з�����Ӧ�Ļ�ѧ����ʽ�� ��
�ڵ�����װ������ͼ��ʾ
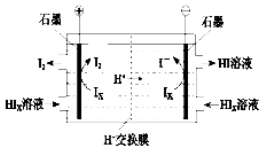
д�������ĵ缫��Ӧʽ ��
��װ���з������ܷ�Ӧ�Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵��û�п�ѧ�Դ������ �� ��
A. ����ѩ����Ư�ۿ���������ɫ������Ȼʧ��ɫ����û����ף�ֻ�и���
B. CO�ж�������ú¯�ľ��ң��ɷ���������ˮ����������Ч������CO����ֹú���ж�
C. �Ȼ��ƾ�����ˮ�Ժͳ����ԣ�������������ˮ��Һ��������·������Ч�ر���·��
D. ��Ԫ���ж�����ֹ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����K2Cr2O7��Һ����FeSO4��Ӧ����Fe3+��Cr3+���ֽ������ữ��K2Cr2O7��Һ��FeSO4��Һ��ϣ���ַ�Ӧ������������Һ�м���KI��Һ�������Һ��Fe3+�����ʵ���������KI�����ʵ����ı仯��ϵ��ͼ��ʾ������˵���в���ȷ���ǣ� ��
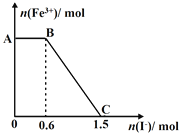
A. ͼ��AB�ε�������ΪK2Cr2O7
B. ͼ��BC�η����ķ�ӦΪ2Fe3++2I-=2Fe2++I2
C. ��ʼ�����K2Cr2O7Ϊ0.25 mol
D. K2Cr2O7����FeSO4��Ӧ�����ʵ���Ϊ1��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��������ܱ������У��������»�ѧ��Ӧ��CO2(g)+H2(g) ![]() CO(g)+H2O(g)���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
CO(g)+H2O(g)���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
t�� | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
��ش��������⣺
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽK�� ��
��2���÷�ӦΪ ��Ӧ��������������������������
��3��830������1L�Ĺ̶��������ܱ������з���1 mol CO��5 mol H2O����Ӧ��ƽ����仯ѧƽ�ⳣ��K 1.0����������������С����������������
��4��830���������еķ�Ӧ�ﵽƽ�⡣�������������������£����������������ƽ�� �ƶ��������������������������淽��������������
��5����1200��ʱ����ijʱ�̸�������CO2��H2��CO��H2O��Ũ�ȷֱ�Ϊ2 mol��L��1��2 mol��L��1��4 mol��L��1��4 mol��L��1�����ʱ������Ӧ��ƽ���ƶ�����Ϊ ��ѡ��������Ӧ�����������淴Ӧ�������������ƶ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ʵ���������;���ж�Ӧ��ϵ����
A���������������ԣ�����������ˮ��������
B������̿���л�ԭ�ԣ�����������ҵ��ɫ��
C���������������ԣ�������������ʴ�̼�
D���������������ԣ�������ʳƷ��ҵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ӧ�úʹ������Ļ��������������������Ҫ���塣
��1����������ԭ���������������ת�����£�![]()
�ٷ�Ӧ��Ϊ��NO��O3��NO2��O2������11.2 L O2(��״��)ʱ��ת�Ƶ��ӵ����ʵ����� mol��
�ڷ�Ӧ���У���n(NO2)��n[CO(NH2)2]��3��2ʱ����Ӧ�Ļ�ѧ����ʽ��_____��
��2����������һ�ֹ��ϵ���������ķ�����ͬʱʵ���˵��������ѭ��ת������Ҫ��ӦΪ��NO2(g)��SO2(g)![]() SO3(g)��NO(g) ��H����41.8 kJ��mol��1
SO3(g)��NO(g) ��H����41.8 kJ��mol��1
��֪��2SO2(g)��O2(g)![]() 2SO3(g) ��H����196.6 kJ��mol��1��д��NO��O2��Ӧ����NO2���Ȼ�ѧ����ʽ ��
2SO3(g) ��H����196.6 kJ��mol��1��д��NO��O2��Ӧ����NO2���Ȼ�ѧ����ʽ ��
��3������[CO(NH2)2]��һ�ָ�Ч������Ҳ��һ�ֻ���ԭ�ϡ�
��������Ϊԭ��һ�������·�����Ӧ��CO(NH2)2 (s) + H2O(l)![]() 2 NH3(g)+CO2(g) ��H = +133.6 kJ/mol���÷�Ӧ�Ļ�ѧƽ�ⳣ���ı���ʽK= �����ڸ÷�Ӧ������˵����ȷ���� �����������
2 NH3(g)+CO2(g) ��H = +133.6 kJ/mol���÷�Ӧ�Ļ�ѧƽ�ⳣ���ı���ʽK= �����ڸ÷�Ӧ������˵����ȷ���� �����������
a���ӷ�Ӧ��ʼ��ƽ��ʱ�����л�������ƽ����Է����������ֲ���
b����ƽ����ϵ������ˮ��������ʹ�÷�Ӧ��ƽ�ⳣ������
c�������¶�ʹ���ص�ת��������
���ܱ��������Ե����ʵ�����NH3��CO2Ϊԭ�ϣ���120 �桢���������·�Ӧ�������أ�CO2(g) +2NH3(g)![]() CO (NH2)2 (s) +H2O(g)�����������NH3�����ʵ����ٷֺ���[(NH3)]��ʱ��仯��ϵ��ͼ��ʾ����a�������Ӧ����V��������CO2�� b����淴Ӧ����V���棩��CO2�������������=������������������ƽ��ת������ ��
CO (NH2)2 (s) +H2O(g)�����������NH3�����ʵ����ٷֺ���[(NH3)]��ʱ��仯��ϵ��ͼ��ʾ����a�������Ӧ����V��������CO2�� b����淴Ӧ����V���棩��CO2�������������=������������������ƽ��ת������ ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Һ�У���ԭ��HSO3�D��I�D��������IO3�D��I2����SO32�D����3molNaHSO3����Һ����μ���KIO3��Һ�������KIO3��������I2�����ʵ����Ĺ�ϵ��������ͼ��ʾ������˵����ȷ����

A��a�㷴Ӧ�Ļ�ԭ����NaHSO3����������Ԫ���ǵ�Ԫ��
B��b�㷴Ӧ�����ӷ���ʽ�ǣ�3HSO3��+IO3��+3OH��=3SO42��+I��+3H2O
C��c�㵽d��ķ�Ӧ�й�ת��0.6mol����
D����200ml 1mol/LKIO3��Һ�еμ�NaHSO3��Һ����Ӧ��ʼʱ�����ӷ���ʽ�ǣ�
5HSO3��+2IO3��=I2+5SO42��+3H++H2O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com