
【题目】一学习小组用100g某硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)制备绿矾(FeSO47H2O),主要流程如图: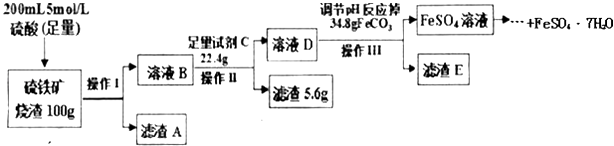
请回答下列问题:
(1)硫铁矿烧渣中加入硫酸酸浸往往需要升温,目的是 , 操作1的名称是 , 滤渣A是 .
(2)试剂C为 , 加入该试剂的目的是(用离子方程式表示).
(3)调节溶液D的pH目的是 .
(4)己知常温下Al(OH)3的Ksp=1.0×10﹣33 , 若溶液中c(Al3+)为1.0mol/L,请计算Al3+开始沉淀的pH= .
(5)依据上述流程中的相关数据,求该硫铁矿烧渣中Fe2O3的质量分数为 . (本实验各操作中损失的硫酸盐、硫酸及调pH后溶液呈微酸性残留的硫酸忽略不计)
【答案】
(1)提高浸取效率;过滤;SiO2
(2)铁粉;2Fe3++Fe=3Fe2+
(3)使Al3+转化为Al(OH)3沉淀
(4)3
(5)48%
【解析】解:硫铁矿烧渣用足量的硫酸浸取,Fe2O3、Al2O3会与硫酸反应,分别生成Fe2(SO4)2和Al2(SO4)2 , 而SiO2不反应,过滤把SiO2除去,然后再向滤液中加入足量的铁粉,将Fe3+转化成Fe2+ , 加入碳酸亚铁调节溶液的pH,使Al3+转化为Al(OH)3沉淀过滤除去,得到FeSO4溶液,再经过加热浓缩、冷却结晶、过滤、洗涤得到FeSO47H2O.(1)升高温度,反应速率加快,可以提高浸取效率;操作1是分离互不相溶的固体与液态,采取过滤操作;滤渣A是SiO2 , 所以答案是:提高浸取效率;过滤;SiO2;(2)试剂C是铁粉,加入足量的铁粉将Fe3+转化成Fe2+ , 反应离子方程式为:2Fe3++Fe=3Fe2+ , 所以答案是:铁粉;2Fe3++Fe=3Fe2+;(3)加入碳酸亚铁调节溶液的pH,使Al3+转化为Al(OH)3沉淀过滤除去,所以答案是:使Al3+转化为Al(OH)3沉淀;(4)溶液中c(Al3+)=1.0mol/L,Ksp[Al(OH)3]=c(Al3+)×c3(OH﹣)=1.0×10﹣33 , 可知开始沉淀时c(OH﹣)=1×10﹣11mol/L,则溶液中c(H+)= ![]() mol/L=1×10﹣3 , 此时溶液pH=﹣lgc(H+)=1×10﹣3=3,所以答案是:3;(5)操作Ⅱ消耗Fe的质量为22.4g﹣5.6g=16.8g,其物质的量为
mol/L=1×10﹣3 , 此时溶液pH=﹣lgc(H+)=1×10﹣3=3,所以答案是:3;(5)操作Ⅱ消耗Fe的质量为22.4g﹣5.6g=16.8g,其物质的量为 ![]() =0.3mol,根据2Fe3++Fe=3Fe2+可知n(Fe3+)=2×0.3mol=0.6mol,故氧化铁的物质的量为
=0.3mol,根据2Fe3++Fe=3Fe2+可知n(Fe3+)=2×0.3mol=0.6mol,故氧化铁的物质的量为 ![]() =0.3mol,Fe2O3的质量分数为
=0.3mol,Fe2O3的质量分数为 ![]() =48%,所以答案是:48%.
=48%,所以答案是:48%.


 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:
【题目】下列关于结构式的叙述中正确的是( )
A.表示组成分子中的各原子在空间的位置
B.以共价键相连的两原子间总以一条短线相连
C.结构式和球棍模型在表示分子结构上作用相同
D.用一条短线表示一对共用电子对的图式反映共价分子中各原子的连接顺序
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙、X是四种中学化学中常见的物质,其转化关系如图所示.则甲和X不可能是( )
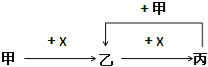
A. 甲为C,X为O2 B. 甲为SO2,X为NaOH溶液
C. 甲为Fe,X为Cl2 D. 甲为AlCl3,X为NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 氯化钠钠晶体不导电是没有离子存在
B. 氯水能导电,但是氯气既不是电解质也不是非电解质
C. KNO3在电流作用下在水中电离出K+和NO3-
D. 用萃取、分液的方法分离汽油和煤油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如图所示变化规律(p表示压强,T表示温度,n表示物质的量): 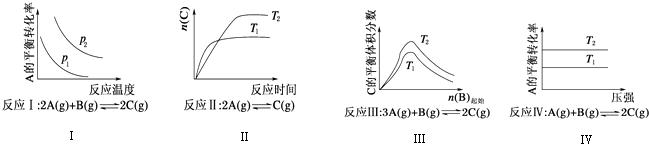
根据以上规律判断,下列结论正确的是( )
A.反应Ⅰ:△H>0,p2>p1
B.反应Ⅲ:△H>0,T2>T1或△H<0,T2<T1
C.反应Ⅱ:△H>0,T1>T2
D.反应Ⅳ:△H<0,T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑
B. 铁粉与氯化铁溶液反应:![]()
C. 氯气与水的反应:Cl2+ H2O ═ 2H+ + Cl- + ClO-
D. 漂白粉溶液中通入过量的CO2:ClO- + CO2 + H2O ═ HClO + HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用熔融碱焙烧工艺可从铝热法生产金属铬的铬渣(Al、Al2O3、Cr2O3等)中浸出铬和铝,为实现铬和铝的再生利用。其工作流程如下:
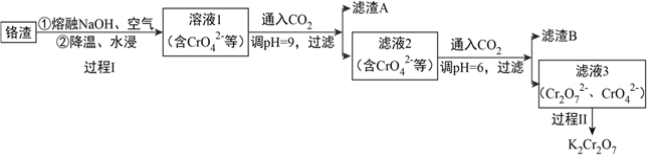
(1)铝热法冶炼金属铬,是利用了金属铝的__________(填“氧化性”或“还原性”)。
(2)溶液1中的阴离子有CrO42-、______、_______。
(3)过程I,在Cr2O3参与的反应中,若生成0.4molCrO42-,消耗氧化剂的物质的量是__________。
(4)通入CO2调节溶液pH实现物质的分离。
①滤渣A煅烧得到Al2O3,再用电解法冶炼Al。冶炼Al的化学方程式是____________________。
②滤渣B受热分解所得物质的参与循环利用,B是__________。
③已知:2CrO42-+2H+ ![]() Cr2O72-+H2O K=4.0×1014
Cr2O72-+H2O K=4.0×1014
滤液3中Cr2O72-的浓度是0.04mol/L,则CrO42-的浓度是__________mol/L。
(5)过程II的目的是得到K2Cr2O7粗品。
不同温度下化合物的溶解度(g/100gH2O)
化合物名称 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 |
K2SO4 | 7.4 | 11.1 | 14.8 | 18.2 | 21.4 |
K2Cr2O7 | 4.7 | 12.3 | 26.3 | 45.6 | 73.0 |
Na2Cr2O7 | 163 | 183 | 215 | 269 | 376 |
结合表中数据分析,过程II的操作是:__________________________,过滤,得到K2Cr2O7粗品。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月18日,中国成为全球首个实现海域成功开采可燃冰的国家,可燃冰是一种甲烷的水合物,下列有关甲烷的说法正确的是
A. 分子式为CH4 B. 极易溶于水 C. 常温下不稳定 D. 是可再生能源
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com