
【题目】CCUS是一种二氧化碳的捕获、利用与封存的技术,这种技术可将CO2资源化,产生经济效益。请回答下列问题:
(1)利用废气中的CO2为原料可制取甲醇。一定条件下,在恒容密闭容器中发生反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
①已知:H2(g)、CH3OH(1)的燃烧热(△H)分别为-285.8kJ·mol-1和-726.5kJ·mol-1;
CH3OH (1)===CH3OH (g) △H=+35.2kJ·mol-1;
H2O(1)===H2O(g) △H=+44kJ·mol-1。
则CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=___________kJ·mol-1。有利于提高H2平衡转化率的条件是___________(填选项字母)。
CH3OH(g)+H2O(g) △H=___________kJ·mol-1。有利于提高H2平衡转化率的条件是___________(填选项字母)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
②某温度下,向体积为2L的容器中充入6molH2、4 mol CO2,发生反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),达到平衡时H2的转化率为50%,其平衡常数为___________(保留两位有效数字)。
CH3OH(g)+H2O(g),达到平衡时H2的转化率为50%,其平衡常数为___________(保留两位有效数字)。
③起始条件(T1℃、2L密闭容器)如表所示:
CO2/mol | H2/mol | CH3OH/mol | H2O/mol | |
I(恒温恒容) | 2 | 6 | 0 | 0 |
II(绝热恒容) | 0 | 0 | 2 | 2 |
达到平衡时,该反应的平衡常数:K(I)___________K(Ⅱ)(填“>”“<”或“=”,下同);平衡时CH3OH的浓度:c(I)___________c(Ⅱ)。
(2)CO2可用来合成低碳烯烃:2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g) △H=-127.8 kJ·mol-1。0.1MPa下,按n(CO2)︰n(H2)=1︰3的投料比充入体积固定的密闭容器中,发生上述反应,不同温度(T)下平衡时的四种气态物质的质量分数(
CH2=CH2(g)+4H2O(g) △H=-127.8 kJ·mol-1。0.1MPa下,按n(CO2)︰n(H2)=1︰3的投料比充入体积固定的密闭容器中,发生上述反应,不同温度(T)下平衡时的四种气态物质的质量分数(![]() )如图所示:
)如图所示:
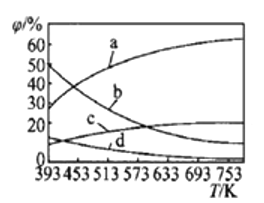
①曲线b、c表示的物质分别为___________、___________(填化学式)。
②保持温度不变,在体积为VL的恒容容器中以n(CO2)︰n(H2)=2︰3的投料比加入反应物,t0时达到化学平衡。t1时将容器体积瞬间扩大至2VL并保持不变,t2时重新达到平衡。请在图中画出容器内混合气体的平均相对分子质量M随时间的变化图象_________。
【答案】-51.7 B 0.05 < < H2O CO2 
【解析】
(1)①H2燃烧的热化学方程式为①H2(g)+![]() O2(g)=H2O(l) △H=-285.8kJ/mol
O2(g)=H2O(l) △H=-285.8kJ/mol
CH3OH燃烧的热化学方程式为:②CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=-726.5kJ/mol
O2(g)=CO2(g)+2H2O(l) △H=-726.5kJ/mol
③CH3OH(1)===CH3OH (g) △H=+35.2kJ·mol-1;
④H2O(1)===H2O(g) △H=+44kJ·mol-1。
将得①×3-②+③+④,得CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的△H=-51.7 kJ·mol-1。该反应的特点是正向放热,气体分子总数减少,所以低温、高压均可以使平衡右移,对提高氢气的转化率有利,所以选择B项。
CH3OH(g)+H2O(g)的△H=-51.7 kJ·mol-1。该反应的特点是正向放热,气体分子总数减少,所以低温、高压均可以使平衡右移,对提高氢气的转化率有利,所以选择B项。
②先以物质的量数据代入列出“三段式”:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),
CH3OH(g)+H2O(g),
初始 4 6 0 0
变化 1 3 1 1
平衡 3 3 1 1
容器的体积为2L,所以平衡时CO2、H2、CH3OH、H2O的物质的量浓度(mol/L)分别为:1.5、1.5、0.5、0.5,据平衡常数的本义式有:![]() ==
==![]() =0.05。
=0.05。
③从题给表格中数据来看,如若二者温度相同,则两个容器为完全等同的两个平衡——一个从反应物投料,一个从产物投料而已。现一个为恒温,一个为绝热,又由于该反应是正向放热的反应,容器II从产物开始投料,反应过程中吸热,导致温度比容器I的要降低。而温度越低,平衡常数越大,所以KI<KII。容器II的反应相当于在容器I的基础上右移,所以平衡时CH3OH的浓度:c(I)<c(Ⅱ);2)①反应2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g) △H=-127.8 kJ·mol-1,正向是一个放热反应,升温,平衡应左移,所以所给图示中,含量减少的b、d是生成物,增加的a、c是反应物,因按n(CO2)︰n(H2)=1︰3的投料而且体积固定,所以a为H2、b为水、c为CO2,d为乙烯,所以答案为H2O、CO2;②反应前混合气体的平均相对分子质量为:
CH2=CH2(g)+4H2O(g) △H=-127.8 kJ·mol-1,正向是一个放热反应,升温,平衡应左移,所以所给图示中,含量减少的b、d是生成物,增加的a、c是反应物,因按n(CO2)︰n(H2)=1︰3的投料而且体积固定,所以a为H2、b为水、c为CO2,d为乙烯,所以答案为H2O、CO2;②反应前混合气体的平均相对分子质量为:![]() =18.8,所以起点坐标为(0,18.8),随着反应的进行,气体的物质的量减小,混合气体的平均相对分子质量增大,至t0时达到化学平衡,如全部转化为乙烯和水,平均相对分子质量为
=18.8,所以起点坐标为(0,18.8),随着反应的进行,气体的物质的量减小,混合气体的平均相对分子质量增大,至t0时达到化学平衡,如全部转化为乙烯和水,平均相对分子质量为![]() 。t1瞬间扩大至2VL并保持不变,t2时重新达到平衡,平均相对分子质量减小,t2时达平衡时相对分子质量应大于18.8。所以图象为:
。t1瞬间扩大至2VL并保持不变,t2时重新达到平衡,平均相对分子质量减小,t2时达平衡时相对分子质量应大于18.8。所以图象为:



科目:高中化学 来源: 题型:
【题目】常温下,用0.10mol·L-1KOH溶液滴定10.00mL0.10mol·L-1H2C2O4(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积看成两者溶液的体积之和),下列说法正确的是
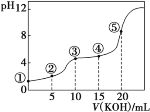
A.点②所示溶液中:c(K+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-)
B.点③所示溶液中:c(K+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
C.点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.15mol·L-1
D.点⑤所示溶液中:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1
2 H2(g)+ O2(g)= 2H2O(g)△H2
C(s)+ O2(g)=CO2(g)△H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为
A. 12△H3+5△H2-2△H1 B. 2△H1-5△H2-12△H3
C. 12△H3-5△H2-2△H1 D. △H1-5△H2-12△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.苯的邻位二元取代物只有一种证明苯没有单双键交替结构
B.乙烯能与溴的四氯化碳溶液发生加成反应使溶液褪色
C.牛油、纤维素和蛋白质都是天然高分子化合物
D.(CH3)2CHCH(CH3)2 的名称是2,3-二甲基丁烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法不正确的是
A.常温下将5.6 g 铁加到足量浓硫酸中,转移电子数为0.3 NA
B.常温常压下,28 g丙烯中所含C-H键的数目为4 NA
C.1 L 3.0 mol·L-1的 NH4Cl溶液中,NH4+ 数目小于3 NA
D.2.0 g重水 (D2O) 中含有的中子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件未标出),其中反应①是置换反应,B、C、F都是气态单质,且B为黄绿色;反应③中有水生成,反应②需要放电才能发生,A和D相遇有白烟生成。
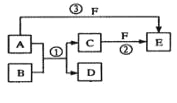
(1)反应③的化学方程式为:_________________;
(2)反应①中每生成1 molC,转移的电子数为______________;
(3)A与D的水溶液恰好完全反应时,其生成物的水溶液呈_____性(填“酸”“碱”或“中”),该水溶液中存在着如下关系,用粒子浓度符号填写。
①c(H+)+____= c(OH-)+ c(Cl-);
②c(H+)= c(OH-)+____;
(4)元素X与组成B的元素同周期,X的单质既可与酸反应也可与碱反应且都生成H2,则
①X的单质与碱反应的离子方程式_____________________________;
②X、空气、海水可以组成新型海水标志灯的电池。该电池以海水为电解质溶液,靠氧气使X不断氧化而源源不断产生电流,只要把灯放入海水中,数分钟后就会发出耀眼的闪光,其能量比干电池高20~50倍。则该新型电池的正极的电极反应式为________________;原电池的总反应方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质之间有如下反应关系:
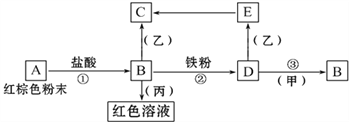
已知由E转化成C的现象是:灰白色沉淀迅速变为灰绿色,最后变为红褐色。
回答:
(1) 写出下列物质的化学式:A______B______D________甲_______乙_______丙__________
(2) 写出E→C反应的化学方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述不正确的是( )
A.试剂X可以是氢氧化钠溶液
B.反应①过滤后所得沉淀为氧化铁
C.图中所示转化反应包含氧化还原反应
D.反应②的化学方程式为2NaAlO2+3H2O+CO2=2Al(OH)3↓+Na2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com