
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 8 g S4中,含有质子数为8NA
B. 1 L pH=l的稀H2SO4中,含有H+数目为0.2 NA
C. 甲烷氯代反应中,消耗l mol Cl2生成HCl分子数为NA
D. 密闭容器中,2 mol NO和lmolO2充分反应后分子总数为2NA
【答案】C
【解析】
A. 8 g S4含S原子的物质的量为![]() 4=0.25mol,一个S原子含有16个质子,则 8 g S4中含有质子数为0.25
4=0.25mol,一个S原子含有16个质子,则 8 g S4中含有质子数为0.25![]() NA=4 NA,故A错误;
NA=4 NA,故A错误;
B. 1 L pH=l的稀H2SO4中,n(H+)=0.1mol/L![]() 1L=0.1mol,则含有H+数目为0.1NA,故B错误;
1L=0.1mol,则含有H+数目为0.1NA,故B错误;
C. 甲烷和氯气的取代反应中,被取代的氢原子的物质的量与氯气的物质的量相等,也等于生成的氯化氢的物质的量,所以消耗l mol Cl2生成HCl分子数为NA,故C正确;
D. 密闭容器中2molNO 与lmolO2充分反应生成的二氧化氮气体中存在2NO2![]() N2O4平衡,产物的分子数少于2NA,故D错误。
N2O4平衡,产物的分子数少于2NA,故D错误。
故答案选C。


科目:高中化学 来源: 题型:
【题目】工业上以钛铁矿(主要成分为钛酸亚铁( FeTiO3),含有MgO、SiO2等杂质)为原料,制备金属钛和铁红的工艺流程如下:

已知:①酸浸时, FeTiO3转化为Fe2+和TO2+;②本实验温度下,Ksp[Mg(OH)2]=1.0×10-11;③溶液中离子浓度小于等于1.0×10-5mol/L时,认为该离子沉淀完全。
请回答下列问题:
(1)酸浸时如何提高浸取速度和浸取率________(至少答两种方法)
(2)“水解”生成H2TiO3的离子方程式为________。
(3)“沉铁”过程中,气态产物的电子式为__________;该过程需控制反应温度低于35℃,原因为_______。
(4)滤液3可用于制备Mg(OH)2。若滤液3中c(Mg2+)=1.2×10-3mo/L,向其中加入NaOH固体,调整溶液pH值大于________时,可使Mg2+恰好沉淀完全。
(5)“电解”时,电解质为熔融的CaO,两电极材料为石墨棒。则_______极石墨棒需要定期更换,原因是________。
(6)测定铁红产品纯度:称取m克铁红,溶于一定量的硫酸之中,配成500.00mL溶液。从其中量取20.00mL溶液,加入过量的KI,充分反应后,用 c mol/L硫代硫酸钠(Na2S2O3)标准液滴定至终点,发生反应:I2+2S2O32-=S4O62-+2I-。平行滴定三次,硫代硫酸钠平均消耗体积为VmL。则铁红产品的纯度为:________(用c、V、m表式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如表:
温 度(℃) | 360 | 440 | 520 |
K值 | 0.036 | 0.010 | 0.0038 |
(1)①由上表数据可知该反应为_____ (填放热,吸热,无法确定 )反应。
②下列措施能用勒夏特列原理解释是_____(填序号)。
a.增大压强有利于合成氨 b.使用合适的催化剂有利于快速生成氨
c.生产中需要升高温度至500°C左右 d.需要使用过量的N2,提高H2转化率
(2)0.2mol氨气溶于水后再与含有0.2mol硫酸的溶液反应放热QkJ,请你用热化学方程式表示其反应式_____。
(3)常温时,将amol氨气溶于水后,再通入bmol氯化氢,溶液体积为1L,且c(NH4+)=c(Cl﹣),则一水合氨的电离平衡常数Kb=_____(用ab表示)。
(4)原料气H2可通过反应 CH4(g)+H2O (g)![]() CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的![]() 恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:

①图中,两条曲线表示压强的关系是:P1_____P2(填“>”、“=”或“<”)。
②其它条件一定,升高温度,氢气的产率会__(填“增大”,“减小”减小,“不变”不变)。
(5)原料气H2还可通过反应CO(g)+H2O(g)![]() CO2(g)+H2(g)获取。
CO2(g)+H2(g)获取。
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08molL﹣1,该温度下反应的平衡常数K值为_____。
②保持温度仍为T℃,容积体积为5L,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是_____(填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知联氨(N2H4)为二元碱,25℃时向联氨水溶液中逐滴滴加盐酸溶液,混合溶液中的微粒的物质的量分数随pOH[pOH=-lgc(OH-)]变化的关系如图所示。已知联氨的两步电离分别为:N2H4+H2O![]() N2H5++OH-,N2H5++H2O
N2H5++OH-,N2H5++H2O![]() N2H62++OH-。下列叙述错误的是
N2H62++OH-。下列叙述错误的是

A. 联氨的第一步电离平衡常数Kb1=10-6
B. pOH=6时c(N2H4)与pOH=15时c(N2H62+)相同
C. 当溶液中c(N2H62+)︰c(N2H5+)=1︰1时,c(H+)=10mol/L
D. pOH由12增大到18时,对应的离子方程式为:N2H5++H+=N2H62+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
具有自主知识产权、中国制造的C919,是一款与波音737MAX同等体量的民用飞机。制造C919需要大量的合金材料,其中包括钢,钢是现代社会的物质基础,钢中除含有铁外还含有碳和少量不可避免的硅、锰、磷、硫等元素。请回答下列有关问题:
(1)基态Mn原子的价电子排布式为___________。
(2)NO3-的立体构型名称为___________,其中心原子的杂化方式为___________。
(3)C、O、Si三种元素第一电离能由大到小的顺序是___________。
(4)写出和CN-互为等电子体的一种离子的电子式___________。
(5)铵盐大多易分解,NH4F和NH4Br两种盐中较易分解的是___________(填化学式);理由是___________。
(6)氧化亚铁晶胞与NaC1的相似,NaCl的晶胞如图所示。由于晶体缺陷,某氧化亚铁晶体的实际组成为Fe0.9O,其中包含有Fe2+和Fe3+,晶胞边长为apm,该晶体的密度为ρg·cm-3,则a=___________(列出计算式即可,用NA表示阿伏加德罗常数的值)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液存在H2CO3/HCO3—、HPO42-/H2PO4—等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值lg x[x表示![]() 或
或![]() ]与pH的关系如图所示。已知碳酸pKal═6.4、磷酸pKa2═7.2 (pKa═ -lgKa)。则下列说法不正确的是
]与pH的关系如图所示。已知碳酸pKal═6.4、磷酸pKa2═7.2 (pKa═ -lgKa)。则下列说法不正确的是

A. 曲线Ⅱ表示lg![]() 与pH的变化关系
与pH的变化关系
B. a~b的过程中,水的电离程度逐渐增大
C. 当c(H2CO3) ═c (HCO3—)时,c(HPO42—)=c(H2PO4—)
D. 当pH增大时,![]() 逐渐增大
逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是
A.现有CO、CO2、O3三种气体,它们都含有1molO,则三种气体的物质的量之比为3:2:1
B.相同条件下,同体积、同密度的C2H4和N2,两种气体的分子数一定相等
C.28gCO和22.4LCO2中含有的碳原子数一定相等
D.配制450mL0.1mol·L-1的NaOH溶液,用托盘天平称取NaOH固体1.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为_______nm(填标号)。
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
(2)基态K原子中,核外电子占据的最高能层的符号是_________,占据该能层电子的电子云轮廓图形状为___________。K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是___________________________。
(3)X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的几何构型为_____________,中心原子的杂化形式为________________。
(4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为______nm,与K紧邻的O个数为__________。
(5)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于______位置,O处于______位置。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资料表明:赤热铜能与NO2反应。某小组设计了如下实验装置进行探究,探究固体产物的成分,气体产物是N2还是NO。
已知:酸性KMnO4溶液能氧化NO生成NO3ˉ;
NO和FeSO4溶液反应:NO+FeSO4=[Fe(NO)]SO4(棕色);
Cu2O+2H+=Cu+Cu2++H2O
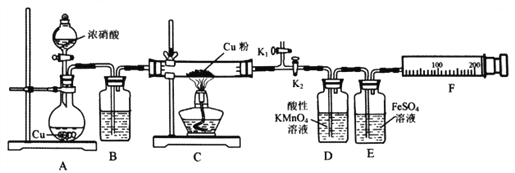
请回答下列问题:
(1)A中反应的化学方程式为________________________。
(2)检查装置气密性,装好药品,然后实验的正确操作顺序是____________
①关闭K1,打开K2 ②打开分液漏斗活塞
③打开K1,关闭K2 ④点燃C处酒精灯
(3)实验过程中,D装置中的现象是____________,能否根据D装置中的现象确认C中有无NO生成? ______,理由是________________________。
(4)E装置的作用是____________。
(5)当铜粉完全反应后,实验小组对反应后的固体成分提出以下猜想:①只有CuO;②只有Cu2O;有同学认为可通过简单的定性实验即可判断猜想①是否成立,其实验方法是_____________________。
(6)实验中E装置自始至终未显棕色,小组最后通过定量实验得到如下数据。
C装置质量 | F装置气体的体积(已折算为标准状况) | ||
玻管质量 | Cu质量 | 反应后(玻管+生成物) | |
mg | 1.92g | (m+2.24)g | 112mL |
据此写出实验时实际发生反应的化学方程式________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com