
【题目】工业上以钛铁矿(主要成分为钛酸亚铁( FeTiO3),含有MgO、SiO2等杂质)为原料,制备金属钛和铁红的工艺流程如下:

已知:①酸浸时, FeTiO3转化为Fe2+和TO2+;②本实验温度下,Ksp[Mg(OH)2]=1.0×10-11;③溶液中离子浓度小于等于1.0×10-5mol/L时,认为该离子沉淀完全。
请回答下列问题:
(1)酸浸时如何提高浸取速度和浸取率________(至少答两种方法)
(2)“水解”生成H2TiO3的离子方程式为________。
(3)“沉铁”过程中,气态产物的电子式为__________;该过程需控制反应温度低于35℃,原因为_______。
(4)滤液3可用于制备Mg(OH)2。若滤液3中c(Mg2+)=1.2×10-3mo/L,向其中加入NaOH固体,调整溶液pH值大于________时,可使Mg2+恰好沉淀完全。
(5)“电解”时,电解质为熔融的CaO,两电极材料为石墨棒。则_______极石墨棒需要定期更换,原因是________。
(6)测定铁红产品纯度:称取m克铁红,溶于一定量的硫酸之中,配成500.00mL溶液。从其中量取20.00mL溶液,加入过量的KI,充分反应后,用 c mol/L硫代硫酸钠(Na2S2O3)标准液滴定至终点,发生反应:I2+2S2O32-=S4O62-+2I-。平行滴定三次,硫代硫酸钠平均消耗体积为VmL。则铁红产品的纯度为:________(用c、V、m表式)
【答案】升温,搅拌,适当增大硫酸浓度,粉碎矿石 TiO2++2H2O= H2TiO3↓+2H+ ![]() 温度过高容易导致NH4HCO3分解(或防止Fe2+、Mg2+等受热水解) 11 阳极 阳极产生氧气与石墨反应生成二氧化碳,导致阳极损耗
温度过高容易导致NH4HCO3分解(或防止Fe2+、Mg2+等受热水解) 11 阳极 阳极产生氧气与石墨反应生成二氧化碳,导致阳极损耗 ![]() %
%
【解析】
(1)酸浸时提高浸取速度和浸取率可以采取升温,搅拌,适当增大硫酸浓度,粉碎矿石。
(2)根据流程图中信息,“水解”时,TiO2+转化为H2TiO3沉淀。
(3)“沉铁”过程中,气态产物为二氧化碳,根据反应物的性质知,温度过高时,碳酸氢铵会分解,Fe2+、Mg2+的水解程度增大。
(4)根据Ksp求。
(5)阳极石墨棒需要定期更换。
(6)根据方程式找出Fe2O3~2S2O32-关系式。
(1)酸浸时提高浸取速度和浸取率可以采取升温,搅拌,适当增大硫酸浓度,粉碎矿石,故答案为:升温,搅拌,适当增大硫酸浓度,粉碎矿石。
(2)根据流程图中信息,“水解”时,TiO2+转化为H2TiO3沉淀,离子方程式为:TiO2++2H2O= H2TiO3↓+2H+,故答案为:TiO2++2H2O= H2TiO3↓+2H+。
(3)“沉铁”过程中,气态产物为二氧化碳,电子式为![]() ,根据反应物的性质知,温度过高时,碳酸氢铵会分解,Fe2+、Mg2+的水解程度增大,故答案为:
,根据反应物的性质知,温度过高时,碳酸氢铵会分解,Fe2+、Mg2+的水解程度增大,故答案为:![]() ;温度过高容易导致NH4HCO3分解(或防止Fe2+、Mg2+等受热水解)。
;温度过高容易导致NH4HCO3分解(或防止Fe2+、Mg2+等受热水解)。
(4)根据Ksp=1.0×10-11=c(Mg2+)c2(OH-)=1×10-5mo/L×c2(OH-),求出c(OH-)=10-3 mo/L,pH=11,故溶液pH值大于11时,可使Mg2+恰好沉淀完全,故答案为:11。
(5)“电解”时,电解质为熔融的CaO,阴极得到Ti,阳极生成O2,阳极石墨棒需要定期更换,原因是阳极产生氧气与石墨反应生成二氧化碳,导致阳极损耗,故答案为:阳极;阳极产生氧气与石墨反应生成二氧化碳,导致阳极损耗。
(6)铁红的成份是Fe2O3,与硫酸反应生成硫酸铁,反应的离子方程式为:Fe2O3+6H+= 2Fe3++3H2O;又知2Fe3++2I-= 2Fe2++I2,I2+2S2O32-=S4O62-+2I-,可得出Fe2O3~2S2O32-,硫代硫酸钠(Na2S2O3)的物质的量为c V×10-3mol,Fe2O3的物质的量为1/2c V×10-3 mol,Fe2O3的质量为80c ×V×10-3g,则铁红产品的纯度为[(80 c ×V×10-3g×![]() )/mg]×100%=(2 c V/m)×100%,故答案为:
)/mg]×100%=(2 c V/m)×100%,故答案为: ![]() %,故答案为:
%,故答案为:![]() %。
%。


科目:高中化学 来源: 题型:
【题目】粗铜精炼后的阳极泥含有Cu、Ag和Au(金)等。湿法处理阳极泥的一种工艺流程如下:

(1)在粗铜精炼过程中,粗铜与电源的__________极(填正、负)连接;阴极的电极反应式为______________________________________________________。
(2)在浸铜过程中,浸铜反应的离子方程式为_______________________________________________________,
生产中实际需要H2O2的量要远远超过浸铜所需的理论用量,可能的原因是________________________________________________。
(3)已知:浸金时,Au转化为AuCl4-。在理论上,提取金的过程中反应消耗NaClO3和H2C2O4的物质的量之比为__________。
(4)已知: 浸银时发生反应AgCl+2SO32-![]() Ag(SO3)23-+Cl-;Ag(SO3)23-将HCHO氧化为CO32-。
Ag(SO3)23-+Cl-;Ag(SO3)23-将HCHO氧化为CO32-。
①为减少废液排放,充分利用资源,向浸银残液中通入气体X得到Na2SO3再生液,X是__________。
②在提取银过程中,其他条件不变,Na2SO3再生液的循环使用次数与银的浸出率关系如图所示。

试结合平衡移动原理,解释产生这种变化的原因_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值。下列说法错误的是
为阿伏加德罗常数的值。下列说法错误的是
A. 0.1mol![]() 和0.1mol
和0.1mol![]() 于密闭容器中充分反应,反应后分子总数为0.2
于密闭容器中充分反应,反应后分子总数为0.2![]()
B. 向过氧化钠中通入足量的二氧化碳,当固体增重28g,转移电子数为l![]()
C. 在标准状况下,22.4LHF与![]() 个
个![]() 中含有的电子数相同
中含有的电子数相同
D. 含有![]() 个
个![]() 胶粒的氢氧化铁胶体中,铁元素的质量大于56g
胶粒的氢氧化铁胶体中,铁元素的质量大于56g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式正确的是( )
A.NaOH电离方程式:NaOH=Na++H++O2-
B.硫酸铝的电离方程式:Al2(SO4)3=Al23++(SO4)32-
C.NaCl的电离方程式:NaCl![]() Na++Cl-
Na++Cl-
D.硫酸氢铵电离方程式:NH4HSO4 =NH4++H++SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,不属于氧化还原反应的是( )
A.H2+Cl2![]() 2HClB.Cl2 + H2O= HCl + HClO
2HClB.Cl2 + H2O= HCl + HClO
C.NH4HCO3![]() NH3↑+CO2↑+H2OD.Zn+H2SO4=H2↑+ZnSO4
NH3↑+CO2↑+H2OD.Zn+H2SO4=H2↑+ZnSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是研究铁钉腐蚀的装置图,下列说法不正确的是
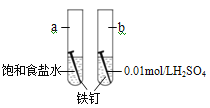
A. 铁钉在两处的腐蚀速率:a < b
B. a、b两处铁钉中碳均正极
C. a、b两处铁钉中的铁均失电子被氧化
D. a、b两处的正极反应式均为O2+4e-+4H+===2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中溶质的物质的量浓度为1mol/L的是( )
A. 将58.5g NaCl溶解在1L水中
B. 将1L 10mol/L的硫酸加入9L水中
C. 将11.2L HCl气体溶于水配成0.5L溶液
D. 将40g NaOH溶解在少量水中,再加蒸馏水直到溶液体积为1L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是
A. H2S在CuSO4溶液中反应的离子方程式:Cu2++S2- = CuS↓
B. H2SO3的电离方程式:H2SO3![]() 2H++SO32-
2H++SO32-
C. HCO3-的水解方程式:HCO3-+H2O![]() H2CO3+OH-
H2CO3+OH-
D. CaCO3的电离方程式:CaCO3 ![]() Ca2++CO32-
Ca2++CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 8 g S4中,含有质子数为8NA
B. 1 L pH=l的稀H2SO4中,含有H+数目为0.2 NA
C. 甲烷氯代反应中,消耗l mol Cl2生成HCl分子数为NA
D. 密闭容器中,2 mol NO和lmolO2充分反应后分子总数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com