
【题目】科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示. 
(1)写出基态Cu原子的核外电子排布式 .
(2)写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来) .
(3)将胆矾溶于水得到天蓝色溶液,往溶液中逐滴加入氨水,现象为 , 反应的离子方程式为 .
(4)已知NF3与NH3的立体结构相同,但NF3不易与Cu2+形成配离子,其原因是 .
【答案】
(1)1s22s22p63s23p63d104s1或[Ar]3d104s1
(2)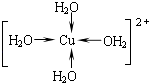
(3)先有蓝色沉淀生成后变为深蓝色溶液;Cu2++2NH3?H2O═Cu(OH)2+2NH4+;Cu(OH)2+4NH3?H2O═Cu(NH3)42++4H2O+2OH﹣
(4)F的电负性比N大,N﹣F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子(或在NF3中氟原子非金属性强,是吸电子的,使得氮原子上的孤对电子难于与Cu2+形成配位键)
【解析】解:(1)铜是29号元素,其原子核外有29个电子,根据构造原理知,其基态原子核外电子排布式为:1s22s22p63s23p63d104s1或[Ar]3d104s1 , 所以答案是:1s22s22p63s23p63d104s1或[Ar]3d104s1;
(2.)CuSO45H2O中铜离子含有空轨道,水分子含有孤对电子对,铜离子与水分子之间形成配位键,铜离子配体数为4.水合铜离子的结构简式为 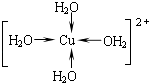 ,所以答案是:
,所以答案是: 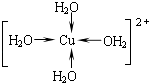 ;
;
(3.)硫酸铜溶液中逐滴滴加氨水至过量,先出现蓝色沉淀,最后溶解形成深蓝色的溶液,反应的离子方程式分别为:Cu2++2NH3H2O═Cu(OH)2+2NH4+;Cu(OH)2+4NH3H2O═Cu(NH3)42++4H2O+2OH﹣ , 所以答案是:先有蓝色沉淀生成后变为深蓝色溶液;Cu2++2NH3H2O═Cu(OH)2+2NH4+;Cu(OH)2+4NH3H2O═Cu(NH3)42++4H2O+2OH﹣;
(4.)F的电负性比N大,N﹣F成键电子对向F偏移,导致NF3中N原子核对其孤电子对的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子,所以答案是:F的电负性比N大,N﹣F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子(或在NF3中氟原子非金属性强,是吸电子的,使得氮原子上的孤对电子难于与Cu2+形成配位键).


科目:高中化学 来源: 题型:
【题目】过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等.实验室可用工业碳酸钙(含MgCO3、FeCO3等杂质)制取纯净的碳酸钙,然后再用纯的碳酸钙制取过氧化钙,其主要流程如下: 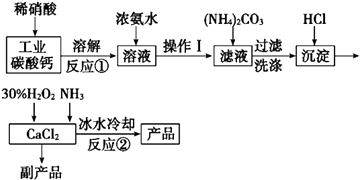
已知:CaO28H2O呈白色微溶于水,加热至350℃左右开始分解放出氧气,425℃分解完全.
(1)写出反应①中氧化还原反应的离子方程式: .
(2)向反应①后的溶液中加浓氨水的目的是: , (用方程式表示)
(3)反应②常用冰水控制温度在0℃左右,其可能原因是(写出两种):①;② .
(4)测定产品中CaO2的含量的实验步骤是
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2mol/L的H2SO4溶液,充分反应.
第二步:向上述锥形瓶中加入几滴淀粉溶液.
第三步:逐滴加入浓度为c molL﹣1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL.已知:I2+2S2O32﹣═2I﹣+S4O62﹣ .
某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能(填“不受影响”“偏低”或“偏高”),原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计).其中能表示等质量的氢气与氦气的是( )
A.
B.
C.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中微粒浓度关系一定正确的是( )
A.室温下,氨水与氯化铵的pH=7的混合溶液中:c(Cl﹣)=c(NH4+)
B.向NaHCO3溶液中加入少量NaOH固体,可抑制HCO3﹣的水解,使c(HCO3﹣)增大
C.0.1 molL﹣1的(NH4)2SO4溶液中:c(NH4+)>c(SO42﹣)>c(H+)>c(OH﹣)
D.常温下,等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和时,a+b=14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钡在氧气中燃烧时的得到一种钡的氧化物晶体,结构如图所示,有关说法正确的是( ) 
A.该晶体为分子晶体
B.晶体的化学式为Ba2O2
C.该晶体晶胞结构与CsCl相似
D.与每个Ba2+距离相等且最近的Ba2+共有12个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中.从废料中回收氧化钴(CoO)的工艺流程如下: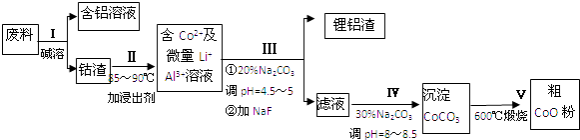
(1)为了提高废料溶浸的效率,可以采取的措施有(写一条即可)
(2)过程Ⅰ中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 .
(3)过程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴.则浸出钴的化学反应方程式为(产物中只有一种酸根) . 在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因 .
(4)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3 , 请写出产生Al(OH)3反应的离子方程式 .
(5)碳酸钠溶液在过程Ⅲ和IV中所起作用有所不同,请写出在过程Ⅳ中起的作用是 .
(6)实验室模拟生产过程V中,必须使用的仪器,除酒精灯、三脚架外,还需、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四种有机化合物均含有多个官能团,其结构简式如下所示,下列有关说法中正确的是( ) 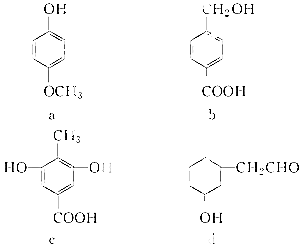
A.a属于酚类,可与NaHCO3溶液反应产生CO2
B.b属于酚类,1 molb最多能与3 molH2发生加成反应
C.1 mol c最多能与3 mol Br2发生反应
D.d属于醇类,可以发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1 mol·L-1的NaOH溶液。整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是
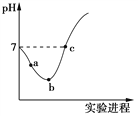
A. 实验进程中水的电离程度:a>c>b
B. c点所示溶液中:c(Na+)=2c(ClO-)+c(HClO)
C. 向a点所示溶液中通入SO2,溶液的pH减小,漂白性增强
D. 由a点到b点的过程中,溶液中![]() 逐渐增大
逐渐增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com