
【题目】一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中.从废料中回收氧化钴(CoO)的工艺流程如下: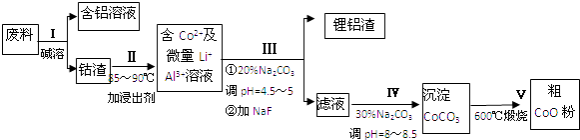
(1)为了提高废料溶浸的效率,可以采取的措施有(写一条即可)
(2)过程Ⅰ中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 .
(3)过程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴.则浸出钴的化学反应方程式为(产物中只有一种酸根) . 在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因 .
(4)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3 , 请写出产生Al(OH)3反应的离子方程式 .
(5)碳酸钠溶液在过程Ⅲ和IV中所起作用有所不同,请写出在过程Ⅳ中起的作用是 .
(6)实验室模拟生产过程V中,必须使用的仪器,除酒精灯、三脚架外,还需、 .
【答案】
(1)搅拌、适当提高温度、粉碎、适当提高溶液浓度等
(2)2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑
(3)4Co2O3?CoO+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O;Co2O3?CoO可氧化盐酸产生Cl2 , 污染环境
(4)2Al3++3CO32﹣+3H2O=2Al(OH)3↓+3CO2↑
(5)调整pH,提供CO32﹣ , 使Co2+沉淀为CoCO3
(6)泥三角;坩埚
【解析】解:操作Ⅰ利用了铝能溶解在氢氧化钠溶液的性质,将铝从废料中分离出来,过滤后得到含Co2O3CoO的钴渣,再用酸溶解过滤后得到含Co3+及Al3+、Li+的滤液,通过调整溶液的pH得到Al(OH)3和LiF沉淀,再过滤得到含Co3+的滤液,再滴加Na2CO3溶液得到CoCO3沉淀,经过滤、洗涤沉淀,最后将CoCO3进行加热分解可得CoO粉末,(1)升高温度、搅拌、减小固体的颗粒等均能加速固体的溶解,所以为了提高溶浸工序中原料的浸出效率,可以采取的措施有:适当升高温度,搅拌,研磨矿石,适当提高稀硫酸的浓度,所以答案是:搅拌、适当提高温度、粉碎、适当提高溶液浓度等;(2)铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子反应方程式为:2Al+2OH﹣+2H2O=+2AlO2﹣+3H2↑,
所以答案是:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;(3)Co3O4和Na2S2O3在酸性条件下发生氧化还原反应生成CoSO4、Na2SO4和H2O,反应方程式为:4Co3O4+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O,所以加入Na2S2O3的作用是还原Co3+ , 盐酸具有还原性,能被Co2O3CoO氧化生成有毒的氯气而污染环境,所以不能盐酸,
所以答案是:4Co2O3CoO+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O;Co2O3CoO可氧化盐酸产生Cl2 , 污染环境;(4)铝离子能与碳酸根离子发生双水解生成氢氧化铝和二氧化碳,水解的离子方程式为:2Al3++3CO32﹣+3H2O=2Al(OH)3↓+3CO2↑,
所以答案是:2Al3++3CO32﹣+3H2O=2Al(OH)3↓+3CO2↑;(5)碳酸钠溶液在过程Ⅲ中铝离子能与碳酸根离子发生双水解生成氢氧化铝和二氧化碳;碳酸钠溶液在过程Ⅳ中调整pH,提供CO32﹣ , 使Co2+沉淀为CoCO3 , 所以答案是:调整pH,提供CO32﹣ , 使Co2+沉淀为CoCO3;(6)过程V为加热固体,常用仪器有酒精灯、三脚架、泥三角、坩埚等,所以答案是:泥三角、坩埚.


科目:高中化学 来源: 题型:
【题目】反应 A+B→C(△H<0)分两步进行 ①A+B→X (△H>0)②X→C(△H<0)下列示意图中,能正确表示总反应过程中能量变化的是( )
A.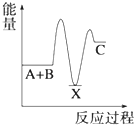
B.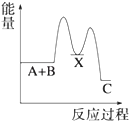
C.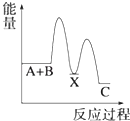
D.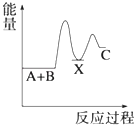
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年10月,中国的女科学家屠呦呦获得诺贝尔生理学或医学奖,理由是她发现了青蒿素,这种药品可以有效降低疟疾患者的死亡率.青蒿素的化学式为C15H22O5 , 易溶于丙酮、乙醚等有机溶剂,故提取青蒿素的方法之一为乙醚浸取法.提取粗品的主要工艺为:
回答下列问题
(1)操作Ⅰ的分离方法是 , 操作Ⅱ的分离方法是 .
(2)青蒿素的摩尔质量为 , 其中碳氧原子的质量比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于分散系的叙述不正确的是( )
A.胶体区别于其他分散系的本质特征是分散质的微粒直径在1﹣100nm之间
B.用平行光照射FeCl3溶液和Fe(OH)3胶体,可以加以区分
C.把FeCl3饱和溶液滴入到蒸馏水中,以制取Fe(OH)3胶体
D.下图图片显示的是树林中的晨曦,该现象与丁达尔现象有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示. 
(1)写出基态Cu原子的核外电子排布式 .
(2)写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来) .
(3)将胆矾溶于水得到天蓝色溶液,往溶液中逐滴加入氨水,现象为 , 反应的离子方程式为 .
(4)已知NF3与NH3的立体结构相同,但NF3不易与Cu2+形成配离子,其原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两份铝,一份加入足量强碱溶液中,另一份加入足量盐酸中,要使前后反应收集到的氢气量之比为1:2,则两份铝质量比为( )
A.1:2
B.2:1
C.1:4
D.1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在湿法炼锌的电解循环溶液中,较高浓度的Cl-会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去Cl-。根据溶液中平衡时相关离子浓度的关系图,下列说法正确的是

A. Ksp(CuCl)的数量级为10-5
B. 加入Cu越多,Cu+浓度越高,除Cl-效果越好
C. 若有32g Cu参加反应,转移电子的数目为NA
D. 除Cl-反应为Cu+Cu2++2 Cl-=2CuCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有24 mL浓度为0.05 mol·L-1的Na2SO3溶液恰好与20 mL某浓度的K2Cr2O7溶液完全反应。已知Na2SO3可被K2Cr2O7氧化为Na2SO4,元素Cr在还原产物中的化合价为+3价,则K2Cr2O7溶液的浓度为( )
A.0.01 mol·L-1B.0.02 mol·L-1C.0.03 mol·L-1D.0.04 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钠在制革工业、印刷工业、电镀工业等有重要用途,铬铁矿的主要成分可表示为FeOCr2O3 , 还含有Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钠(Na2Cr2O7)的流程图:
(1)煅烧前应将铬铁矿充分粉碎,其目的是。灼烧是中学化学中常用的操作方法,如在实验室中将铬铁矿和碳酸钠固体混合物灼烧,以下各实验仪器中不需要的是。
a.陶瓷坩埚 b.铁坩埚 c.三脚架 d.泥三角
(2)转窑中发生的主要反应为:
①Na2CO3+Al2O3![]() 2NaAlO2+CO2↑;
2NaAlO2+CO2↑;
② FeOCr2O3+ Na2CO3+ O2![]() Na2CrO4+ Fe2O3+ 。
Na2CrO4+ Fe2O3+ 。
请配平反应②的化学方程式。
(3)生成固体Y的离子方程式为。
(4)向母液中加入浓硫酸,把铬酸钠转化为重铬酸钠,经两次蒸发,主要是除去(填化学式),冷却至30~40℃得到产品晶体。洗涤该晶体的溶剂最好是(填序号)。
a.蒸馏水 b.无水乙醇 c.75%乙醇溶液
(5)为了测定实验制得的产品中Na2Cr2O7的含量,称取样品0.140g置于锥形瓶中,加50mL水;再加入2gKI(过量)及稍过量的稀硫酸溶液,摇匀,暗处放置10min;然后加150mL蒸馏水并加入3mL 0.5%淀粉溶液;用0.1000mol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液30.00mL。(假定杂质不参加反应,已知:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,I2+2S2O32-=2I-+S4O62-)
①终点实验现象是。
②该产品中Na2Cr2O7的纯度为。(以质量分数表示)
③若滴定管在滴定前俯视读数,滴定结束后仰视读数,测得样品的纯度将(填“偏高”、或“偏低”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com