
【题目】下列关于分散系的叙述不正确的是( )
A.胶体区别于其他分散系的本质特征是分散质的微粒直径在1﹣100nm之间
B.用平行光照射FeCl3溶液和Fe(OH)3胶体,可以加以区分
C.把FeCl3饱和溶液滴入到蒸馏水中,以制取Fe(OH)3胶体
D.下图图片显示的是树林中的晨曦,该现象与丁达尔现象有关
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】已知:CH3COOH═CH3COO﹣+H+达到电离平衡时,电离平衡常数可以表示为Ka= ![]() ;CH3COO﹣+H2O═CH3COOH+OH﹣达到水解平衡时,水解平衡常数可以表示为Kh=
;CH3COO﹣+H2O═CH3COOH+OH﹣达到水解平衡时,水解平衡常数可以表示为Kh= ![]() ,(式中各粒子浓度均为平衡时浓度).
,(式中各粒子浓度均为平衡时浓度).
(1)对于任意弱电解质来讲,其电离平衡常数Ka、对应离子的水解常数Kh以及水的离子积常数Kw的关系是 , 由此可以推断,弱电解质的电离程度越小,其对应离子的水解程度 . 如在25℃ 时碳酸的K1草酸的K1(填“大于”、“等于”或“小于”),所以,在相同条件下,碳酸氢钠的溶液显性,而草酸氢钠溶液显酸性.
(2)由于CH3COOH的电离程度很小,计算时可将CH3COOH的平衡浓度看成是CH3COOH溶液的浓度,则c molL﹣1的CH3COOH溶液中c(H+)=(不为0).
(3)现用某未知浓度(设为c′)的CH3COOH溶液及其他仪器、药品,通过实验测定一定温度下CH3COOH的电离平衡常数,需测定的数据有(用简要的文字说明):
①实验时的温度;
②;
③用(填一种实验方法)测定溶液浓度c′.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子反应可用H++OH﹣=H2O表示的是( )
A.Cu(OH)2与H2SO4
B.Ba(OH)2与H2SO4
C.Fe(OH)3与HCl
D.HNO3与KOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可用于合成除草剂、杀草丹等农药。H2S与CO2在高温下反应可制得COS: H2S(g)+CO2(g)![]() COS(g) +H2O(g) △H > 0。在 2 L 容器中充入一定量的H2S和CO2发生上述反应,数据如下:
COS(g) +H2O(g) △H > 0。在 2 L 容器中充入一定量的H2S和CO2发生上述反应,数据如下:

下列判断不正确的是( )
A. K1=l/81
B. 实验2中平衡时的c(COS)约为0.0286 mol·L-1
C. 初始反应速率:实验3 >实验2 >实验1
D. K2=K3 且n3=2n2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中微粒浓度关系一定正确的是( )
A.室温下,氨水与氯化铵的pH=7的混合溶液中:c(Cl﹣)=c(NH4+)
B.向NaHCO3溶液中加入少量NaOH固体,可抑制HCO3﹣的水解,使c(HCO3﹣)增大
C.0.1 molL﹣1的(NH4)2SO4溶液中:c(NH4+)>c(SO42﹣)>c(H+)>c(OH﹣)
D.常温下,等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和时,a+b=14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明醋酸是弱电解质,几位同学分别选用下列试剂进行实验:0.10 mol·L-1醋酸溶液、0.10 mol·L-1CH3COONa溶液、pH=3的盐酸、pH=3的醋酸、CH3COONa晶体、NaCl晶体、甲基橙、pH试纸、蒸馏水。
(1)甲用pH试纸测得0.10 mol·L-1CH3COONa溶液的pH>7,则可以认定醋酸是弱电解质。用化学方程式解释pH>7的原因________________________________________
(2)乙取出10 mL 0.10 mol·L-1醋酸溶液,滴入几滴甲基橙试剂,溶液显红色,然后再加入0.001mol醋酸钠晶体,溶液颜色变为橙色,则可以认定醋酸是弱电解质。则溶液中
①c(Na+)_____c(CH3COOH)(填“>”、“=”或 “<”)
②2c(H+)-2c(OH-) ____c(CH3COO-)-c(CH3COOH)(填“>”、“=”或 “<”)
(3)丙用pH试纸测出0.10 mol·L-1的醋酸溶液pH=4,则认定醋酸是弱电解质,你认为这一方法正确吗?_______。 (填“正确”或“不正确”)
(4)丁取出10 mL 0.10 mol·L-1的醋酸溶液,用pH试纸测出其pH=a,然后用蒸馏水稀释到1000mL,再用pH试纸测定其pH=b,若醋酸是弱电解质,则a、b应该满足的关系是__________(用“不等式”表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中.从废料中回收氧化钴(CoO)的工艺流程如下: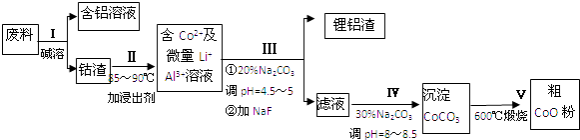
(1)为了提高废料溶浸的效率,可以采取的措施有(写一条即可)
(2)过程Ⅰ中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 .
(3)过程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴.则浸出钴的化学反应方程式为(产物中只有一种酸根) . 在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因 .
(4)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3 , 请写出产生Al(OH)3反应的离子方程式 .
(5)碳酸钠溶液在过程Ⅲ和IV中所起作用有所不同,请写出在过程Ⅳ中起的作用是 .
(6)实验室模拟生产过程V中,必须使用的仪器,除酒精灯、三脚架外,还需、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产中产生的SO2、NO直接排放将对大气造成严重污染。利用化学原理吸收SO2和NO,同时获得Na2S2O4和NH4NO3产品的工艺流程图如下(Ce为铈元素):

请回答下列问题:
(1)写出装置I中主要发生反应的离子方程式_______________________;
装置Ⅱ中NO在酸性条件下生成NO3-的离子方程式______________________。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω(纵坐标)与溶液pH(横坐标)的关系如下图所示:
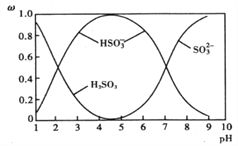
①下列说法不正确的是__________(填标号)
A. 为获得尽可能纯的NaHSO3,应将溶液的pH控制在4~5为宜
B. pH=7时,溶液中:c(Na+)<c(HSO3-)+c(SO32-)
C. pH=9时,溶液中:c(OH-)=c(H+)+c(HSO3-)+2c(H2SO3)
②由图中数据,可以计算出H2SO3的第二级电离平衡常数K2约为_______
(3)向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,其pH降为2,结合化学平衡移动原理用有关的化学用语解释溶液pH降低的原因______________。
(4)已知进入装置Ⅳ的溶液中NO2-的浓度为0.4mol·L-1,要使1m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2的体积为__________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸铁锂电池具有高效率输出、可快速充电、对环境无污染等优点,其工作原理如图。M电极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种
能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式
为LixC6+Li1-xFePO4 ![]() LiFePO4+6C。下列说法正确的是( )
LiFePO4+6C。下列说法正确的是( )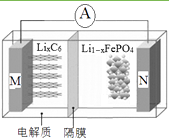
A.放电时Li+从右边移向左边
B.放电时M是负极,电极反应式为:C6x--xe-=6C
C.充电时N极连接电源的正极,电极反应式为:LiFePO4-xe-=Li1-xFePO4+xLi+
D.充电时电路中通过0.5mol电子,消耗36gC
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com