
【题目】工业生产中产生的SO2、NO直接排放将对大气造成严重污染。利用化学原理吸收SO2和NO,同时获得Na2S2O4和NH4NO3产品的工艺流程图如下(Ce为铈元素):

请回答下列问题:
(1)写出装置I中主要发生反应的离子方程式_______________________;
装置Ⅱ中NO在酸性条件下生成NO3-的离子方程式______________________。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω(纵坐标)与溶液pH(横坐标)的关系如下图所示:
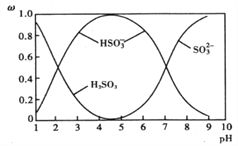
①下列说法不正确的是__________(填标号)
A. 为获得尽可能纯的NaHSO3,应将溶液的pH控制在4~5为宜
B. pH=7时,溶液中:c(Na+)<c(HSO3-)+c(SO32-)
C. pH=9时,溶液中:c(OH-)=c(H+)+c(HSO3-)+2c(H2SO3)
②由图中数据,可以计算出H2SO3的第二级电离平衡常数K2约为_______
(3)向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,其pH降为2,结合化学平衡移动原理用有关的化学用语解释溶液pH降低的原因______________。
(4)已知进入装置Ⅳ的溶液中NO2-的浓度为0.4mol·L-1,要使1m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2的体积为__________L。
【答案】 SO2 + OH-=HSO3- 3Ce4++NO+2H2O=NO3-+3Ce3++4H+ B 10-7 HSO3-SO32-+H+,加入CaCl2溶液,Ca2++SO32-= CaSO3↓,使平衡右移,c(H+)增大 4480
【解析】装置Ⅰ中二氧化硫是酸性氧化物,能和强碱氢氧化钠反应:SO2+OH-=HSO3-,NO和氢氧化钠之间不会反应,装置Ⅱ中NO在酸性条件下,NO和Ce4+之间会发生氧化还原反应:NO+H2O+Ce4+=Ce3++NO2-+2H+,NO+2H2O+3Ce4+=3Ce3++NO3-+4H+,装置Ⅲ中,在电解槽的阳极2Ce3+-2e-=2Ce4+,阴极电极反应式为:2HSO3-+2H++2e-=S2O42-+2H2O,装置Ⅳ中通入氨气、氧气,2NO2-+O2+2H++2NH3=2NH4++2NO3-。
(1)根据上述分析,装置Ⅰ中二氧化硫是酸性氧化物,能和强碱氢氧化钠反应:SO2+OH-=HSO3-;装置Ⅱ中NO在酸性条件下生成NO3-的离子方程式为NO+2H2O+3Ce4+=3Ce3++NO3-+4H+,故答案为:SO2+OH-=HSO3-;NO+2H2O+3Ce4+=3Ce3++NO3-+4H+;
(2)①A.溶液的pH控制在4~5时,c(HSO3- )浓度最大,则为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右,故A正确;B.pH=7时,溶液呈中性,c(H+)=c(OH-),溶液中存在电荷守恒:c(H+)+c(Na+)=c(HSO3-)+2c(SO32-)+c(OH-),故溶液中c(Na+)=c(HSO3-)+2c(SO32-),故B错误;C.溶液存在质子守恒,应为c(OH-)=c(H+)+c(HSO3-)+2c(H2SO3),故C正确;故答案为: B;
②HSO3-SO32-+H+,由图中数据,pH=7时,c(HSO3- )=c(SO32- ),由Ka的表达式可知,H2SO3的第二级电离平衡常数K2≈c(H+)=10-7,故答案为:10-7;
(3)NaHSO3溶液中HSO3-的电离大于水解,HSO3- ![]() SO32-+H+,溶液显示酸性,加入CaCl2溶液后,Ca2++SO32-=CaSO3↓,使电离平衡右移,故答案为:HSO3-在溶液中存在电离平衡:HSO3-
SO32-+H+,溶液显示酸性,加入CaCl2溶液后,Ca2++SO32-=CaSO3↓,使电离平衡右移,故答案为:HSO3-在溶液中存在电离平衡:HSO3- ![]() SO32-+H+,加CaCl2溶液后,Ca2++SO32-=CaSO3↓使电离平衡右移,c(H+)增大;
SO32-+H+,加CaCl2溶液后,Ca2++SO32-=CaSO3↓使电离平衡右移,c(H+)增大;
(4)NO2-的浓度为0.4mol/L,要使1m3该溶液中的NO2-完全转化为NH4NO3,则失去电子数为:1000×(5-3)×0.4mol,设消耗标况下氧气的体积是V,根据电子守恒: ![]() ×4=1000×(5-3)×0.4mol,解得V=4480L,故答案为:4480。
×4=1000×(5-3)×0.4mol,解得V=4480L,故答案为:4480。


科目:高中化学 来源: 题型:
【题目】下列关于价电子构型3s23p4的描述正确的是( )
A.它的元素符号为O
B.它的核外电子排布式为1s22s22p63s23p4
C.它的氢化物的电子式为 ![]()
D.其电子排布图为 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于分散系的叙述不正确的是( )
A.胶体区别于其他分散系的本质特征是分散质的微粒直径在1﹣100nm之间
B.用平行光照射FeCl3溶液和Fe(OH)3胶体,可以加以区分
C.把FeCl3饱和溶液滴入到蒸馏水中,以制取Fe(OH)3胶体
D.下图图片显示的是树林中的晨曦,该现象与丁达尔现象有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两份铝,一份加入足量强碱溶液中,另一份加入足量盐酸中,要使前后反应收集到的氢气量之比为1:2,则两份铝质量比为( )
A.1:2
B.2:1
C.1:4
D.1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在湿法炼锌的电解循环溶液中,较高浓度的Cl-会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去Cl-。根据溶液中平衡时相关离子浓度的关系图,下列说法正确的是

A. Ksp(CuCl)的数量级为10-5
B. 加入Cu越多,Cu+浓度越高,除Cl-效果越好
C. 若有32g Cu参加反应,转移电子的数目为NA
D. 除Cl-反应为Cu+Cu2++2 Cl-=2CuCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,氢离子浓度都为1×10-2 mol·L-1的盐酸和醋酸各100 mL,分别稀释2倍后,再分别加入003 g Zn粉,在相同条件下充分反应,下列有关叙述正确的是
A. 稀释2倍后,两溶液的pH:盐酸小于醋酸
B. 盐酸和醋酸分别与Zn反应放出的氢气一样多
C. 盐酸和醋酸分别与Zn反应的速率一样大
D. 稀释2倍前,醋酸溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有24 mL浓度为0.05 mol·L-1的Na2SO3溶液恰好与20 mL某浓度的K2Cr2O7溶液完全反应。已知Na2SO3可被K2Cr2O7氧化为Na2SO4,元素Cr在还原产物中的化合价为+3价,则K2Cr2O7溶液的浓度为( )
A.0.01 mol·L-1B.0.02 mol·L-1C.0.03 mol·L-1D.0.04 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究黑色固体X(仅含两种元素)的组成和性质,设计并完成如下实验:
请回答:
① X的化学式是________。
② 固体甲与稀硫酸反应的离子方程式是________。
③ 加热条件下氨气被固体X氧化成一种气体单质,写出该反应的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列化学反应的离子方程式的是( )
A.氢氧化钡溶液与硫酸的反应:OH﹣+H+=H2O
B.澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O
C.铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag
D.二氧化碳与足量的氢氧化钠反应:CO2+2OH﹣=CO ![]() +H2O
+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com