
【题目】下列关于价电子构型3s23p4的描述正确的是( )
A.它的元素符号为O
B.它的核外电子排布式为1s22s22p63s23p4
C.它的氢化物的电子式为 ![]()
D.其电子排布图为 ![]()
科目:高中化学 来源: 题型:
【题目】下列解释事实的化学方程式或离子方程式不正确的是( )
A.工业上可角电解法制备Mg:MgCl2(熔融) ![]() Mg+C12↑
Mg+C12↑
B.用FeSO4除去酸性废水中的Cr2O72﹣:Cr2O72﹣+Fe2++14H+═2Cr3++Fe3++7H2O
C.用CaSO4治理盐碱地:CaSO4(s)+Na2CO3(aq)?CaCO3(s)+Na2SO4(aq)
D.向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO﹣+H2O+CO2═2HClO+CaCO3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3COOH═CH3COO﹣+H+达到电离平衡时,电离平衡常数可以表示为Ka= ![]() ;CH3COO﹣+H2O═CH3COOH+OH﹣达到水解平衡时,水解平衡常数可以表示为Kh=
;CH3COO﹣+H2O═CH3COOH+OH﹣达到水解平衡时,水解平衡常数可以表示为Kh= ![]() ,(式中各粒子浓度均为平衡时浓度).
,(式中各粒子浓度均为平衡时浓度).
(1)对于任意弱电解质来讲,其电离平衡常数Ka、对应离子的水解常数Kh以及水的离子积常数Kw的关系是 , 由此可以推断,弱电解质的电离程度越小,其对应离子的水解程度 . 如在25℃ 时碳酸的K1草酸的K1(填“大于”、“等于”或“小于”),所以,在相同条件下,碳酸氢钠的溶液显性,而草酸氢钠溶液显酸性.
(2)由于CH3COOH的电离程度很小,计算时可将CH3COOH的平衡浓度看成是CH3COOH溶液的浓度,则c molL﹣1的CH3COOH溶液中c(H+)=(不为0).
(3)现用某未知浓度(设为c′)的CH3COOH溶液及其他仪器、药品,通过实验测定一定温度下CH3COOH的电离平衡常数,需测定的数据有(用简要的文字说明):
①实验时的温度;
②;
③用(填一种实验方法)测定溶液浓度c′.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定温度下,在三个等体积的恒容密闭容器中,反应2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g)达平衡,下列说法正确的是( )
C2H5OH(g)+3H2O(g)达平衡,下列说法正确的是( )
容器 | 温度/K | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | |||
CO2(g) | H2(g) | C2H5OH(g) | H2O(g) | C2H5OH(g) | ||
甲 | 500 | 0.20 | 0.60 | 0 | 0 | 0.083 |
乙 | 500 | 0.40 | 1.20 | 0 | 0 | |
丙 | 600 | 0 | 0 | 0.10 | 0.30 | 0.039 |
A. 该反应正反应为吸热反应
B. 达平衡时,甲、乙容器内:2c(CO2,甲)<c(CO2,乙)
C. 达平衡时,容器甲中的逆反应速率比容器乙中的大
D. 达平衡时,转化率:a(CO2,甲)+a(C2H5OH,丙)>1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水氯化铝是一种重要的化工原料,工业上利用明矾石制备无水氯化铝的流程如图,请回答下列问题: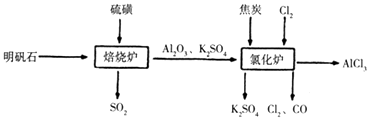
(1)实验室中,可制得Cl2的组合是(填代号).
①MnO2和浓盐酸混合共热 ②MnO2、NaCl和浓硫酸混合共热
③NaClO和盐酸混合共热 ④漂白粉和硫酸混合共热
(2)吸收焙烧炉中产生的尾气,下列装置合理的是(填代号).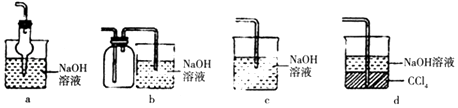
(3)写出氧化炉中反应的化学方程式
(4)生产氯化铝的过程中焙烧炉和氯化炉中产生的SO2、Cl2等大气污染物,若将二者按照一定比例通入水中可减少污染.试设计简单实验检验二者是否恰好完全反应,简要描述实验步骤、现象和结论(仪器自选).
可供选择试剂如下:
①滴加酚酞的氢氧化钠溶液 ②氯化亚铁溶液 ③硫氰化钾溶液 ④品红溶液
(5)某同学设计用如图装置验证二氧化硫的某些化学性质.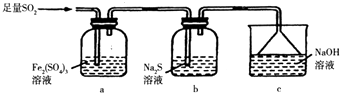
①能说明二氧化硫具有氧化性的实验现象为 .
②写出a瓶中发生反应的离子方程式 .
③充分反应后,取a瓶中的溶液分成三份,分别进行如下实验.
实验I:向第一份溶液中加入足量的NaOH溶液,生成白色沉淀,迅速变为灰绿色,最终变为红褐色.
实验II:向第二份溶液中加入少量KMnO4溶液,紫色褪去.
实验III:向第三份溶液中加入BaCl2溶液,生成白色沉淀.
上述实验中能充分证明二氧化硫具有还原性的是:(填实验代号).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是部分短周期元素的常见化合价与原子序数的关系图:
(1)元素F在周期表中的位置 .
(2)DH其所含化学键类型为 .
(3)C、D、G对应的简单离子半径大小顺序是 . (用离子符号回答)
(4)某同学设计实验装置如图2,证明A、B、F的非金属性强弱关系:①溶液a和溶液b分别为 , .
②溶液c中的离子反应方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子反应可用H++OH﹣=H2O表示的是( )
A.Cu(OH)2与H2SO4
B.Ba(OH)2与H2SO4
C.Fe(OH)3与HCl
D.HNO3与KOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可用于合成除草剂、杀草丹等农药。H2S与CO2在高温下反应可制得COS: H2S(g)+CO2(g)![]() COS(g) +H2O(g) △H > 0。在 2 L 容器中充入一定量的H2S和CO2发生上述反应,数据如下:
COS(g) +H2O(g) △H > 0。在 2 L 容器中充入一定量的H2S和CO2发生上述反应,数据如下:

下列判断不正确的是( )
A. K1=l/81
B. 实验2中平衡时的c(COS)约为0.0286 mol·L-1
C. 初始反应速率:实验3 >实验2 >实验1
D. K2=K3 且n3=2n2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产中产生的SO2、NO直接排放将对大气造成严重污染。利用化学原理吸收SO2和NO,同时获得Na2S2O4和NH4NO3产品的工艺流程图如下(Ce为铈元素):

请回答下列问题:
(1)写出装置I中主要发生反应的离子方程式_______________________;
装置Ⅱ中NO在酸性条件下生成NO3-的离子方程式______________________。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω(纵坐标)与溶液pH(横坐标)的关系如下图所示:
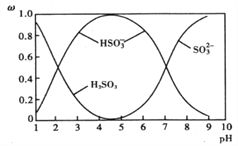
①下列说法不正确的是__________(填标号)
A. 为获得尽可能纯的NaHSO3,应将溶液的pH控制在4~5为宜
B. pH=7时,溶液中:c(Na+)<c(HSO3-)+c(SO32-)
C. pH=9时,溶液中:c(OH-)=c(H+)+c(HSO3-)+2c(H2SO3)
②由图中数据,可以计算出H2SO3的第二级电离平衡常数K2约为_______
(3)向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,其pH降为2,结合化学平衡移动原理用有关的化学用语解释溶液pH降低的原因______________。
(4)已知进入装置Ⅳ的溶液中NO2-的浓度为0.4mol·L-1,要使1m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2的体积为__________L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com