
【题目】为探究黑色固体X(仅含两种元素)的组成和性质,设计并完成如下实验:
请回答:
① X的化学式是________。
② 固体甲与稀硫酸反应的离子方程式是________。
③ 加热条件下氨气被固体X氧化成一种气体单质,写出该反应的化学方程式________。
【答案】
【解析】解:解答本题的思路:先根据现象确定X的组成元素,再根据数据计算组成元素的原子个数比。隔绝空气分解得到能使呆火星木条复燃,说明有氧元素,固体甲与硫酸反应得到的蓝色溶液中含有Cu2+ , 紫红色固体乙为Cu,得出固体甲即为Cu2O,从而确定X由Cu和O组成,Cu2O为2.88/144=0.02mol,Cu为0.04mol,X中O为(3.2-0.04×64)/16=0.04mol,所以X为CuO。加热条件下氨气被CuO氧化成一种气体单质为N2 , CuO被还原成Cu单质,根据升降守恒、原子守恒配平方程式 2NH3 + 3CuO== N2 + 3H2O + 3Cu。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可用于合成除草剂、杀草丹等农药。H2S与CO2在高温下反应可制得COS: H2S(g)+CO2(g)![]() COS(g) +H2O(g) △H > 0。在 2 L 容器中充入一定量的H2S和CO2发生上述反应,数据如下:
COS(g) +H2O(g) △H > 0。在 2 L 容器中充入一定量的H2S和CO2发生上述反应,数据如下:

下列判断不正确的是( )
A. K1=l/81
B. 实验2中平衡时的c(COS)约为0.0286 mol·L-1
C. 初始反应速率:实验3 >实验2 >实验1
D. K2=K3 且n3=2n2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产中产生的SO2、NO直接排放将对大气造成严重污染。利用化学原理吸收SO2和NO,同时获得Na2S2O4和NH4NO3产品的工艺流程图如下(Ce为铈元素):

请回答下列问题:
(1)写出装置I中主要发生反应的离子方程式_______________________;
装置Ⅱ中NO在酸性条件下生成NO3-的离子方程式______________________。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω(纵坐标)与溶液pH(横坐标)的关系如下图所示:
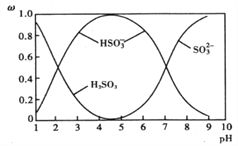
①下列说法不正确的是__________(填标号)
A. 为获得尽可能纯的NaHSO3,应将溶液的pH控制在4~5为宜
B. pH=7时,溶液中:c(Na+)<c(HSO3-)+c(SO32-)
C. pH=9时,溶液中:c(OH-)=c(H+)+c(HSO3-)+2c(H2SO3)
②由图中数据,可以计算出H2SO3的第二级电离平衡常数K2约为_______
(3)向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,其pH降为2,结合化学平衡移动原理用有关的化学用语解释溶液pH降低的原因______________。
(4)已知进入装置Ⅳ的溶液中NO2-的浓度为0.4mol·L-1,要使1m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2的体积为__________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次(从左至右)发生反应的类型和条件都正确的是( )
选项 | 反应类型 | 反应条件 |
A | 加成反应、取代反应、消去反应 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
B | 消去反应、加成反应、取代反应 | NaOH醇溶液/加热、常温、NaOH水溶液/加热 |
C | 氧化反应、取代反应、消去反应 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
D | 消去反应、加成反应、水解反应 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2 , 再继续向两溶液中逐滴加入0.1 mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如图所示,试回答下列问题: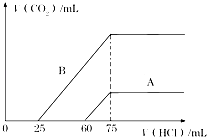
(1)原NaOH溶液的物质的量浓度为 .
(2)曲线A表明,原NaOH溶液中通入CO2后,所得溶液中的溶质成分是 , 其物质的量之比为 .
(3)曲线B表明,原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,用0.1000 mol·L-1NaOH溶液滴定20. 00 mL 0.1000 mol·L-1CH3COOH溶液,所得滴定曲线如右图。下列说法正确的是
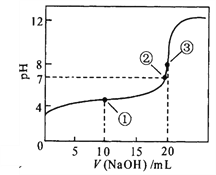
A. 点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH) +c( H+)
B. 点②所示溶液中:c(Na+)=c(CH3COOH)+ c(CH3COO-)
C. 点③所示溶液中:c(Na+)>c(OH-)> c( CH3COO-) >c( H+)
D. 滴定过程中会出现:c(CH3COOH)>c( CH3COO-)>c(H+) >c( Na+)>c( OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸铁锂电池具有高效率输出、可快速充电、对环境无污染等优点,其工作原理如图。M电极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种
能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式
为LixC6+Li1-xFePO4 ![]() LiFePO4+6C。下列说法正确的是( )
LiFePO4+6C。下列说法正确的是( )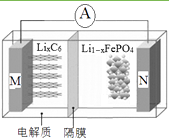
A.放电时Li+从右边移向左边
B.放电时M是负极,电极反应式为:C6x--xe-=6C
C.充电时N极连接电源的正极,电极反应式为:LiFePO4-xe-=Li1-xFePO4+xLi+
D.充电时电路中通过0.5mol电子,消耗36gC
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非诺洛芬是一种治疗类风湿性关节炎的药物,可通过以下方法合成: 
请回答下列问题:
(1)非诺洛芬中的含氧官能团为和(填名称).
(2)反应①中加入的试剂X的分子式为C8H8O2 , X的结构简式为 .
(3)在上述五步反应中,属于取代反应的是(填序号).
(4)B的一种同分异构体满足下列条件:
Ⅰ、能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应.
Ⅱ、分子中有6种不同化学环境的氢,且分子中含有两个苯环.
写出该同分异构体的结构简式: .
(5)根据已有知识并结合相关信息,写出以 ![]() 为原料制备
为原料制备  的合成路线流程图(无机试剂任用),合成路线路程图示例如下:
的合成路线流程图(无机试剂任用),合成路线路程图示例如下:
CH3CH2Br ![]() CH3CH2OH
CH3CH2OH ![]() CH3COOCH2CH3 .
CH3COOCH2CH3 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL的某稀H2S04溶液中滴入0.1mol/L氨水,溶液中水电离出氢离子浓度随滴人氨水体积变化如图.下列分析正确的是( ) 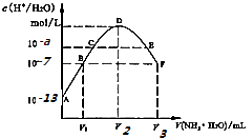
A.稀硫酸的浓度为0.1mol/L
B.C点溶液pH=14﹣a
C.E溶液中存在:c(NH4+)>c(SO42﹣)>c(H+)>c(OH﹣)
D.B到D,D到F所加氨水体积一定相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com