
【题目】两份铝,一份加入足量强碱溶液中,另一份加入足量盐酸中,要使前后反应收集到的氢气量之比为1:2,则两份铝质量比为( )
A.1:2
B.2:1
C.1:4
D.1:1
科目:高中化学 来源: 题型:
【题目】—定温度下,在三个等体积的恒容密闭容器中,反应2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g)达平衡,下列说法正确的是( )
C2H5OH(g)+3H2O(g)达平衡,下列说法正确的是( )
容器 | 温度/K | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | |||
CO2(g) | H2(g) | C2H5OH(g) | H2O(g) | C2H5OH(g) | ||
甲 | 500 | 0.20 | 0.60 | 0 | 0 | 0.083 |
乙 | 500 | 0.40 | 1.20 | 0 | 0 | |
丙 | 600 | 0 | 0 | 0.10 | 0.30 | 0.039 |
A. 该反应正反应为吸热反应
B. 达平衡时,甲、乙容器内:2c(CO2,甲)<c(CO2,乙)
C. 达平衡时,容器甲中的逆反应速率比容器乙中的大
D. 达平衡时,转化率:a(CO2,甲)+a(C2H5OH,丙)>1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可用于合成除草剂、杀草丹等农药。H2S与CO2在高温下反应可制得COS: H2S(g)+CO2(g)![]() COS(g) +H2O(g) △H > 0。在 2 L 容器中充入一定量的H2S和CO2发生上述反应,数据如下:
COS(g) +H2O(g) △H > 0。在 2 L 容器中充入一定量的H2S和CO2发生上述反应,数据如下:

下列判断不正确的是( )
A. K1=l/81
B. 实验2中平衡时的c(COS)约为0.0286 mol·L-1
C. 初始反应速率:实验3 >实验2 >实验1
D. K2=K3 且n3=2n2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明醋酸是弱电解质,几位同学分别选用下列试剂进行实验:0.10 mol·L-1醋酸溶液、0.10 mol·L-1CH3COONa溶液、pH=3的盐酸、pH=3的醋酸、CH3COONa晶体、NaCl晶体、甲基橙、pH试纸、蒸馏水。
(1)甲用pH试纸测得0.10 mol·L-1CH3COONa溶液的pH>7,则可以认定醋酸是弱电解质。用化学方程式解释pH>7的原因________________________________________
(2)乙取出10 mL 0.10 mol·L-1醋酸溶液,滴入几滴甲基橙试剂,溶液显红色,然后再加入0.001mol醋酸钠晶体,溶液颜色变为橙色,则可以认定醋酸是弱电解质。则溶液中
①c(Na+)_____c(CH3COOH)(填“>”、“=”或 “<”)
②2c(H+)-2c(OH-) ____c(CH3COO-)-c(CH3COOH)(填“>”、“=”或 “<”)
(3)丙用pH试纸测出0.10 mol·L-1的醋酸溶液pH=4,则认定醋酸是弱电解质,你认为这一方法正确吗?_______。 (填“正确”或“不正确”)
(4)丁取出10 mL 0.10 mol·L-1的醋酸溶液,用pH试纸测出其pH=a,然后用蒸馏水稀释到1000mL,再用pH试纸测定其pH=b,若醋酸是弱电解质,则a、b应该满足的关系是__________(用“不等式”表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中.从废料中回收氧化钴(CoO)的工艺流程如下: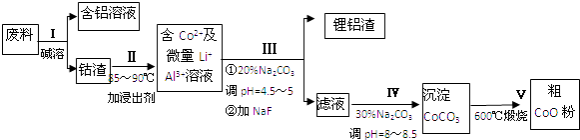
(1)为了提高废料溶浸的效率,可以采取的措施有(写一条即可)
(2)过程Ⅰ中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 .
(3)过程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴.则浸出钴的化学反应方程式为(产物中只有一种酸根) . 在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因 .
(4)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3 , 请写出产生Al(OH)3反应的离子方程式 .
(5)碳酸钠溶液在过程Ⅲ和IV中所起作用有所不同,请写出在过程Ⅳ中起的作用是 .
(6)实验室模拟生产过程V中,必须使用的仪器,除酒精灯、三脚架外,还需、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是研究部分元素氢化物的沸点变化规律的图象,折线c可以表达出第族元素氢化物的沸点变化规律.两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线﹣﹣折线a和折线b,你认为正确的是(填“a”或“b”),理由是 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产中产生的SO2、NO直接排放将对大气造成严重污染。利用化学原理吸收SO2和NO,同时获得Na2S2O4和NH4NO3产品的工艺流程图如下(Ce为铈元素):

请回答下列问题:
(1)写出装置I中主要发生反应的离子方程式_______________________;
装置Ⅱ中NO在酸性条件下生成NO3-的离子方程式______________________。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω(纵坐标)与溶液pH(横坐标)的关系如下图所示:
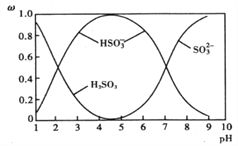
①下列说法不正确的是__________(填标号)
A. 为获得尽可能纯的NaHSO3,应将溶液的pH控制在4~5为宜
B. pH=7时,溶液中:c(Na+)<c(HSO3-)+c(SO32-)
C. pH=9时,溶液中:c(OH-)=c(H+)+c(HSO3-)+2c(H2SO3)
②由图中数据,可以计算出H2SO3的第二级电离平衡常数K2约为_______
(3)向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,其pH降为2,结合化学平衡移动原理用有关的化学用语解释溶液pH降低的原因______________。
(4)已知进入装置Ⅳ的溶液中NO2-的浓度为0.4mol·L-1,要使1m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2的体积为__________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次(从左至右)发生反应的类型和条件都正确的是( )
选项 | 反应类型 | 反应条件 |
A | 加成反应、取代反应、消去反应 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
B | 消去反应、加成反应、取代反应 | NaOH醇溶液/加热、常温、NaOH水溶液/加热 |
C | 氧化反应、取代反应、消去反应 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
D | 消去反应、加成反应、水解反应 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非诺洛芬是一种治疗类风湿性关节炎的药物,可通过以下方法合成: 
请回答下列问题:
(1)非诺洛芬中的含氧官能团为和(填名称).
(2)反应①中加入的试剂X的分子式为C8H8O2 , X的结构简式为 .
(3)在上述五步反应中,属于取代反应的是(填序号).
(4)B的一种同分异构体满足下列条件:
Ⅰ、能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应.
Ⅱ、分子中有6种不同化学环境的氢,且分子中含有两个苯环.
写出该同分异构体的结构简式: .
(5)根据已有知识并结合相关信息,写出以 ![]() 为原料制备
为原料制备  的合成路线流程图(无机试剂任用),合成路线路程图示例如下:
的合成路线流程图(无机试剂任用),合成路线路程图示例如下:
CH3CH2Br ![]() CH3CH2OH
CH3CH2OH ![]() CH3COOCH2CH3 .
CH3COOCH2CH3 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com