
����Ŀ�������������ܣ����γɵ�һ�������1Co��NH3��5NO2]Cl2���Ʊ�������ͼ�� ![]()
��1��Co2+��̬��������Ų�ʽΪ ��
��2�������1Co��NH3��5Cl]Cl2����Co3+�γ���λ����ԭ��Ϊ����Ԫ�ط��ţ��������� 1Co��NH3��5NO2]2+�������е�ԭ�ӵ��ӻ��������Ϊ ��
��3����NO2����Ϊ�ȵ�����ĵ��ʷ���Ϊ��д��ѧʽ����
��4��H2O2��H2O��������������ܣ�����Ϊ���Ƕ��Ǽ��Է����⣬����Ϊ ��
��5������������ˮ���п�ת��Ϊǿ�°�����������������NDMA�Ľṹ��ʽ��ͼ ![]() ��ʾ��1molNDMA�����к��ЦҼ�����ĿΪmol��
��ʾ��1molNDMA�����к��ЦҼ�����ĿΪmol��
���𰸡�
��1��[Ar]3d7��1s22s22p63s23p63d7
��2��N��Cl��sp2��sp3
��3��O3
��4��H2O2��H2O֮������γ����
��5��10
���������⣺��1��Co2+����25�����ӣ���̬��������Ų�ʽΪ[Ar]3d7��1s22s22p63s23p63d7 �� ���Դ��ǣ�[Ar]3d7��1s22s22p63s23p63d7��
2�������1Co��NH3��5Cl]Cl2�е����������ṩ�¶Ե��Ӷ���Co3+�γ���λ����Co��NH3��5NO2]2+��������NH3�е�ԭ�ӵ��ӻ��������Ϊsp3 �� ��NO2���е�ԭ�ӵ��ӻ��������Ϊsp2 �� ���Դ��ǣ�N��Cl��sp2��sp3��
3��NO2���ĵ�����Ϊ24����ȵ�����ΪO3 �� ���Դ��ǣ�O3��
4��H2O2��H2O֮������γ�������ܽ��������H2O2��H2O��������������ܣ����Դ��ǣ�H2O2��H2O֮������γ������
5��˫����һ���м���һ���Ҽ���1molNDMA�С��ṹ��ʽ��ͼ ![]() ����6molC��H��2molC��N��1molN��N��1molN��O�Ҽ�����10mol�Ҽ������Դ��ǣ�10��
����6molC��H��2molC��N��1molN��N��1molN��O�Ҽ�����10mol�Ҽ������Դ��ǣ�10��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܹ��ⶨ���ӽṹ�ͻ�ѧ���ķ�����(����)
A.����
B.�������
C.�������
D.�˴Ź�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.6molX�����0.6mol Y��������2L�ܱ������У�ʹ���Ƿ������·�Ӧ��2X��g��+Y��g��=nZ��g��+2W��g����2minĩ������0.2mol W������֪��Z��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.1molL��1min��1 �� ���㣺
��1��ǰ2min����X��Ũ�ȱ仯��ʾ��ƽ����Ӧ���ʣ�
��2��2minĩʱY��Ũ�ȣ�
��3����ѧ��Ӧ����ʽ��n��ֵ�Ƕ��٣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȥ������������������(�����ڵ�����)��ѡ�õ��Լ�����ȷ����(����)
A.����(������)��NaOH��Һ
B.����(��Ȳ)����ˮ
C.��(������)��NaOH��Һ
D.��Ȳ(����)����������������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Թ��м���2-3mLҺ���ټ��ȣ���ȷ�IJ���˳���� �� ��
�ٵ�ȼ�ƾ��ƽ��м��ȣ������Թ��м���2-3mLҺ�壻
�����Թܼмг����Թܵ����ϲ����ܽ��Լ�ƿ��ƿ�ǸǺã�����ԭ����
A. �ڢۢܢ� B. �ۢڢܢ� C. �ڢܢۢ� D. �ۢڢ٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.������ȼ����Ϊ��H=��285.5kJ?mol��1 �� ����ˮ���Ȼ�ѧ����ʽΪ2H2O��l�� ![]() 2H2��g��+O2��g����H=+285.5k?Jmol��1
2H2��g��+O2��g����H=+285.5k?Jmol��1
B.��ӦSO2��g��+2H2S��g���T3S��s��+2H2O��l���ڳ��������Է����У���÷�Ӧ�ġ�H��0
C.500�桢30MPa�£���0.5molN2��1.5molH2�����ܱյ������г�ַ�Ӧ����NH3��g��������19.3kJ�����Ȼ�ѧ����ʽΪ��N2��g��+3H2��g���T2NH3��g����H=��38.6k?Jmol��1
D.��C��ʯī��s��=C�����ʯ��s����H=+1.90 k?Jmol��1��֪�����ʯ��ʯī�ȶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л�����ҩ���������м��壬��ṹ��ʽ��ͼ�������й�������ȷ���ǣ� �� 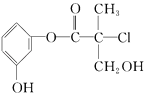
A.���л���������ˮ�����ӳɷ�Ӧ
B.���л�����Ũ�����ϼ��ȿɷ�����ȥ��Ӧ
C.1mol���л���������NaOH��Һ��Ӧ�������3mol NaOH
D.���л��ᆳ���������ܷ���������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʲ�����ͬ���칹�����(����)
A.2,2-����������2-������
B.���ȼױ��Ͷ��ȼױ�
C.2-�����������
D.�Ҵ��ͱ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��WΪ���ֶ�����Ԫ�أ�����YԪ��ԭ�Ӻ�������������������Ӳ�����3�������������ڱ��е����λ������ͼ��ʾ��
X | Y | |
Z | W |
��ش��������⣺
��1��Wλ�����ڱ��е����ڣ����壻
��2��X���γ�˫ԭ�ӷ��ӣ�����ӵĵ���ʽ����Y����Ԫ���γɵ�10�������г�����+1��������Ϊ���ѧʽ����ͬ����Z����Ԫ���γɵ�18�������г����ĩ�1��������Ϊ��
��3����ҵ�Ͻ������W����ͨ�����ڵ�Z�����п��Ƶû�����Z2W2 �� �����ʿ���ˮ��Ӧ����һ����ʹƷ����Һ��ɫ�����壬0.2mol�����ʲμӷ�Ӧʱת��0.3mol���ӣ�����ֻ��һ��Ԫ�ػ��ϼ۷����ı䣬д��Z2W2��ˮ��Ӧ�Ļ�ѧ����ʽ
��4����һ�������£���Ԫ��Y��Z��ɵ�һ����̬������ɷ�����������Ӧ����Ӧ��ƽ�����������̬���ʹ��棬��֪ÿת��4mol���ӷ���190.0kJ���÷�Ӧ���Ȼ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com