
【题目】元素X、Y、Z 位于相同短周期,它们的最高及最低化合价如表所示,下列判断错误的是
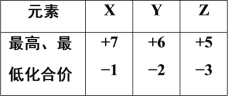
A.原子序数:X>Y>Z
B.原子半径:X>Y>Z
C.稳定性:HX>H2Y>ZH3
D.酸性由强到弱:HXO4>H2YO4>H3ZO4
科目:高中化学 来源: 题型:
【题目】工业上以浓缩海水(含较高浓度的Br-)为原料提取溴的部分流程如下:
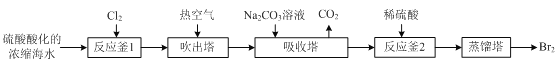
已知:3Br2+3CO32- =5Br- +BrO3- +3CO2↑。
图甲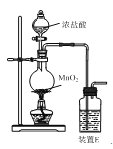 图乙
图乙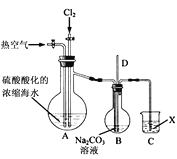
(1)反应用的Cl2可由图甲所示装置制取,制取Cl2的化学方程式为____。为除去Cl2中挥发出的HCl,装置E中所盛溶液是____。
(2)实验室用图乙所示装置模拟流程中的部分过程。
①通入Cl2时发生反应的离子方程式为____。
②通入热空气的作用是____。
③烧杯C中所盛溶液是____。
④烧瓶B中的长导管D起着平衡压强的作用,当烧瓶内气体压强过大时,可以观察到的现象是____。
(3)“反应釜2”中所发生反应的离子方程式为____。
(4)蒸馏后,蒸馏塔溶液中仍溶有少量Br2,可以向其中加入少量____萃取其中的Br2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器,aA(g)![]() bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.物质B的质量分数增加了B.物质A的转化率减少了
C.平衡向逆反应方向移动了D.a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验测得16 g甲醇[CH3OH(l)]在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25 kJ的热量,试写出甲醇燃烧热的热化学方程式:___。
(2)从化学键的角度分析,化学反应的过程就是反应物的化学键被破坏和生成物的化学键的形成过程。已知反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH=akJ·mol-1。有关键能数据如下:
2NH3(g) ΔH=akJ·mol-1。有关键能数据如下:
化学键 | H—H | N—H | N≡N |
键能(kJ·mol-1) | 436 | 391 | 945 |
试根据表中所列键能数据计算a=____。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算。
已知:C(s,石墨)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599kJ·mol-1
根据盖斯定律,计算298 K时由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的反应热为:ΔH=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、科技等密切相关,下列说法错误的是( )
A.开发利用太阳能、风能和氢能等新能源代替化石能源,利于实现低碳经济
B.利用膜材料将含油污水中的油水分离,发生的是化学变化
C.依照Cu![]() CuO
CuO![]() Cu(NO3)2的反应制取Cu(NO3)2符合不易产生污染的绿色化学理念
Cu(NO3)2的反应制取Cu(NO3)2符合不易产生污染的绿色化学理念
D.屠呦呦从青蒿中提取青蒿素对治疗疟疾有特效
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.向某溶液中滴加少量AgNO3溶液,有白色沉淀产生,溶液中一定含有Cl-
B.向某溶液中加入一定量的稀硫酸,产生的气体使澄清石灰水变浑浊,溶液中一定含有SO32-或CO32-
C.将灼热的木炭与浓硝酸反应产生的气体缓缓通入澄清石灰水中,溶液没有沉淀产生
D.向某溶液中滴加少量浓NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝,说明该溶液中一定不含NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类是学习的一种重要方法,“价一类”二维图对学习化学知识具有重要的指导意义。物质的化学反应常与外界条件密切相关。回答下列问题:
(1)含有同一元素的X、Y、Z、E、M五种物质,一定条件下有以下的转化关系。
![]()
①若E为红棕色气体,则该气体的收集方法为___;X分子含有10个电子,则气体X水溶液中离子有___。
②若Y为淡黄色固体单质,写出Z→E的化学反应方程式___。
(2)盐酸、硫酸、硝酸是工业生产中常用的三种强酸。
①盐酸既有酸性,又能表现氧化性和还原性,其还原产物是___;若足量的MnO2与100mL12mol·L-1的浓盐酸反应,生成Cl2的物质的量___0.3mol(填:“大于”、“等于”、“小于”)。
②足量的锌与浓硫酸反应,反应开始时的化学方程式为___;反应快结束时的离子反应方程式为___。
③将6.4g铜与足量的浓硝酸反应,产生NO和NO2气体的体积为2.24L(STP),则参加反应的硝酸的物质的量为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、NH4+、Mg2+、Al3+、CO32-、SO42-中的几种。
①若加入锌粒,最终产生无色无味的气体;
②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示,则下列说法正确的是( )
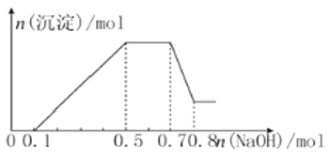
A. 溶液中的阳离子只有H+、Mg2+、Al3+
B. 溶液中n(NH4+)=0.2 mol
C. 溶液中一定不含CO32-,可能含有SO42-
D. n(H+)∶n(Al3+)∶n(Mg2+)=1∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研人员提出HCHO(甲醛)与O2在羟基磷灰石(HAP)表面催化生成H2O的历程,该历程示意图如下(图中只画出了 HAP的部分结构):

下列说法不正确的是
A. HAP能提高HCHO与O2的反应速率
B. HCHO在反应过程中,有C-H键发生断裂
C. 根据图示信息,CO2分子中的氧原子全部来自O2
D. 该反应可表示为:HCHO+O2![]() CO2+H2O
CO2+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com