
【题目】我国目前大多数工厂以铬铁矿(主要成份为 FeO·Cr2O3,还含有Al2O3、MgO等杂质)为主要原料生产二水合重铬酸钠(Na2Cr2O7·2H2O),其主要工艺流程如下图所示。 步骤①中涉及的主要反应是:
4FeO·Cr2O3+8Na2CO3+7O2=8Na2CrO4+2Fe2O3+8CO2。
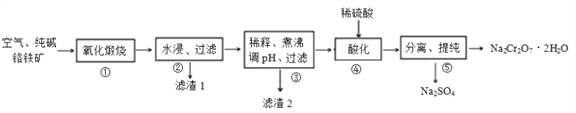
回答下列问题:
(1)二水合重铬酸钠(Na2Cr2O7·2H2O)中Cr的化合价为 ______, 氧化煅烧时将铬铁矿粉碎的目的是 ____________。
(2)①中杂质 Al2O3 与纯碱反应转变为可溶性盐,写出 Al2O3与纯碱反应的化学方程式________,滤渣1的主要成分为MgO和_______( 填化学式) 。
(3)滤渣2的成分是___________( 填化学式) 。
(4)步骤④,向滤液中加入稀硫酸,溶液由黄色变为橙色,得到Na2Cr2O7和 Na2SO4的混合溶液,发生反应的离子方程式为__________。
(5)该工艺的酸性废液中含有Cr2O72-,向废液中加入绿矾(FeSO4·7H2O)还原处理,反应的离子方程式是__________; 再向处理后的溶液中加入石灰水,使 c(Cr3+)降至10-5mol/L, 此时溶液的pH值为 ______(已知:该条件下,Ksp[Cr(OH)3]=1.0×10-32)。
【答案】 +6 价 增大接触面积,加快铬铁矿煅烧速率 Al2O3+ Na2CO3 ![]() 2NaAlO2+ CO2↑ Fe2O3 Al(OH)3 2H+ +2CrO42-= 2H2O + Cr2O72- Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3++ 7H2O 5
2NaAlO2+ CO2↑ Fe2O3 Al(OH)3 2H+ +2CrO42-= 2H2O + Cr2O72- Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3++ 7H2O 5
【解析】铬铁矿通过焙烧,生成Na2CrO4、Fe2O3、MgO和NaAlO2的混合体系,然后加水溶解得固体Fe2O3、MgO和溶液Na2CrO4、NaAlO2,再调节溶液的PH,使偏铝酸盐完全沉淀,继续调节溶液的PH使CrO42-转化为Cr2O72-。
(1)由化合价代数和为0,设Cr的化合价为x,2+2x-7×2=0,二水合重铬酸钠(Na2Cr2O7·2H2O)中Cr的化合价为+6价;氧化煅烧时将铬铁矿粉碎的目的是:增大接触面积,加快铬铁矿煅烧速率;
(2)Al2O3与纯碱反应的化学方程式Al2O3+ Na2CO3 ![]() 2NaAlO2+ CO2↑;滤渣1的主要成分为MgO和Fe2O3 (3)NaAlO2,调节溶液的PH,使偏铝酸盐完全沉淀,滤渣2的成分是 Al(OH)3 ;(4)再加H2SO4溶液由黄色变为橙色,得到Na2Cr2O7和 Na2SO4的混合溶液,离子方程2H+ +2CrO42-= 2H2O + Cr2O72- ;(5)Cr2O72-具有强氧化性,用Fe2+ 将其还原, Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3++ 7H2O (6)Ksp[Cr(OH)3]=1.0×10-32=c(Cr3+ )C(OH― )3=10-5mol/L,C(OH― )3,C(OH― )=10-9mol/L,PH=5。
2NaAlO2+ CO2↑;滤渣1的主要成分为MgO和Fe2O3 (3)NaAlO2,调节溶液的PH,使偏铝酸盐完全沉淀,滤渣2的成分是 Al(OH)3 ;(4)再加H2SO4溶液由黄色变为橙色,得到Na2Cr2O7和 Na2SO4的混合溶液,离子方程2H+ +2CrO42-= 2H2O + Cr2O72- ;(5)Cr2O72-具有强氧化性,用Fe2+ 将其还原, Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3++ 7H2O (6)Ksp[Cr(OH)3]=1.0×10-32=c(Cr3+ )C(OH― )3=10-5mol/L,C(OH― )3,C(OH― )=10-9mol/L,PH=5。


科目:高中化学 来源: 题型:
【题目】由碳、氮、磷、硫等元素组成的蛋白质,在体内经过消化、吸收后,最后氧化成酸,对应的酸不正确的是( )
A. 碳→碳酸 B. 硫→硫酸 C. 氮→硝酸 D. 磷→磷酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述涉及的化学相关知识,其中说法正确的是( )
A.植物油可以作为萃取剂分离出碘水中的碘
B.石油的分馏、煤的气化、海水制镁都包括化学变化
C.处理废水时加入明矾作为消毒剂,可以除去水中的杂质
D.乙烯、甲烷、SO2三种无色气体可用溴水鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol/L NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
A.60 mL B.45 mL C.30 mL D.15 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.计算以下数值(均为25℃时)
(1)某浓度的NH3·H2O溶液中,由水电离的c(H+)=1×10-12mol/L,该溶液的 pH=_________
(2)将pH=3的H2SO4 溶液和pH=12的NaOH溶液混合, 混合后所得溶液的PH=10,则H2SO4 溶液与NaOH溶液的体积比为______________
(3)向0.02mol/L的MgCl2溶液中加入NaOH固体,若要生成Mg(OH)2沉淀,溶液的pH最低为__________(已知Ksp[Mg(OH)2]=3.2×10-11,lg2.5=0.4)
II.(1)盐碱地因含较多的![]() ,使得土壤呈碱性,不利于作物生长,通过施加适量石膏粉末(主要含有CaSO4,微溶于水)来降低土壤的碱性。写出该过程中发生反应的化学方程式_______________________________
,使得土壤呈碱性,不利于作物生长,通过施加适量石膏粉末(主要含有CaSO4,微溶于水)来降低土壤的碱性。写出该过程中发生反应的化学方程式_______________________________
(2)![]() 是一种无色或淡黄色液体,遇水剧烈反应得到二氧化硫和氯化氢,是一种常用的脱水剂。将
是一种无色或淡黄色液体,遇水剧烈反应得到二氧化硫和氯化氢,是一种常用的脱水剂。将![]() 与
与![]() 混合并加热,可得到无水
混合并加热,可得到无水![]() ,得到无水
,得到无水![]() 的化学方程式为______________________________
的化学方程式为______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),图1表示该反应进行过程中能量(单位为kJ·mol—1)的变化。
CH3OH(g)+H2O(g),图1表示该反应进行过程中能量(单位为kJ·mol—1)的变化。

(1)写出该反应的热化学方程式__________________________。
(2)关于该反应的下列说法中,正确的是___________。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(3)该反应的平衡常数K的表达式为:________________。
(4)温度降低,平衡常数K____________(填“增大”、 “不变”或“减小”)。
(5)为探究反应原理,现进行如下实验:在体积为1 L的密闭容器中,充入1 molCO2和3 molH2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v (H2)=______________________。
(6)下列措施中能使n(CH3OH)/n(CO2)增大的有____________。
A.升高温度 B.加入催化剂
C.将H2O(g)从体系中分离 D.充入He(g),使体系总压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液的叙述正确的是( )
A. 常温下,同浓度的Na2CO3与NaHCO3溶液相比,Na2CO3溶液的pH大
B. 常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH![]() )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
C. 中和pH与体积均相同的盐酸和醋酸,消耗NaOH的物质的量相同
D. 将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com