
ЁОЬтФПЁПЯТЭМБэЪОМИжжЮоЛњЮяжЎМфЕФзЊЛЏЙиЯЕЃЌЦфжаAЁЂBОљЮЊКкЩЋЗлФЉЃЌBЮЊЗЧН№ЪєЕЅжЪЃЌCЮЊЮоЩЋЮоЖОЦјЬхЃЌDЮЊН№ЪєЕЅжЪЃЌEЪЧКьзиЩЋЦјЬхЃЌGЪЧОпгаЦЏАзадЕФЦјЬхЃЌHЕФЫЎШмвКГЪРЖЩЋЁЃ

ЧыЛиД№ЯТСаЮЪЬтЃК
(1)AЕФЛЏбЇЪНЪЧ___ЃЌCЕФЕчзгЪНЪЧЁЁ__________ЁЁЃЌYЕФУћГЦЪЧ_____ЁЃ
(2)ЗДгІЂйЕФЛЏбЇЗНГЬЪНЮЊЁЁ__________________________ЁЃ
(3)ЪЕбщЪвВтЖЈЦјЬхEЕФЯрЖдЗжзгжЪСПЪБЃЌЕУЕНЕФЪЕбщжЕзмЪЧБШРэТлжЕЦЋДѓЃЌЦфдвђЪЧ(гУЛЏбЇЗНГЬЪНБэЪО)ЁЁ_________________ЁЃ
(4)19.2gЕФDгызуСПЕФвЛЖЈХЈЖШXЕФШмвКЗДгІЃЌНЋЫљЕУЕФЦјЬхгы_______L O2(БъзМзДПіЯТ)ЛьКЯЃЌЧЁКУФмБЛЫЎЭъШЋЮќЪеЁЃ
ЁОД№АИЁПCuO ![]() ХЈСђЫс CЃЋ4HNO3(ХЈ)=CO2ЁќЃЋ4NO2ЁќЃЋ2H2O 2NO2N2O4 3.36L
ХЈСђЫс CЃЋ4HNO3(ХЈ)=CO2ЁќЃЋ4NO2ЁќЃЋ2H2O 2NO2N2O4 3.36L
ЁОНтЮіЁП
вбжЊЃЌAЁЂBОљЮЊКкЩЋЗлФЉЃЌBЮЊЗЧН№ЪєЕЅжЪЃЌCЮЊЮоЩЋЮоЖОЦјЬхЃЌDЮЊН№ЪєЕЅжЪЃЌПЩЭЦВтAЮЊCuOЃЌBЮЊCЃЌCЮЊЖўбѕЛЏЬМЃЌDЮЊCuЃЛEЪЧКьзиЩЋЦјЬхЮЊЖўбѕЛЏЕЊЃЌGЪЧОпгаЦЏАзадЕФЦјЬхЮЊЖўбѕЛЏСђЃЌHЕФЫЎШмвКГЪРЖЩЋЮЊСђЫсЭЁЃ
(1)ЗжЮіПЩжЊЃЌAЮЊбѕЛЏЭЃЌЛЏбЇЪНЪЧCuOЃЛCЮЊЖўбѕЛЏЬМЃЌЕчзгЪНЮЊЃК![]() ЃЛYЮЊХЈСђЫсЃЛ
ЃЛYЮЊХЈСђЫсЃЛ
(2)ЗДгІЂйЮЊЬМгыХЈЯѕЫсЗДгІЩњГЩЖўбѕЛЏЬМЁЂЖўбѕЛЏСђКЭЫЎЃЌЗНГЬЪНЮЊЃКCЃЋ4HNO3(ХЈ)=CO2ЁќЃЋ4NO2ЁќЃЋ2H2OЃЛ
(3)бщЪвВтЖЈЦјЬхЖўбѕЛЏЕЊЕФЯрЖдЗжзгжЪСПЪБЃЌДцдкПЩФцЗДгІ2NO2N2O4ЕУЕНЕФЪЕбщжЕзмЪЧБШРэТлжЕЦЋДѓЃЛ
(4)19.2gЕФCuМД0.3molЃЌгызуСПЕФвЛЖЈХЈЖШЕФЯѕЫсШмвКЗДгІЃЌЩњГЩЕЊЕФбѕЛЏЮяЃЌЛЏКЯМлНЕЕЭгыCuЩ§ИпЕФЛЏКЯМлзмЪ§ЯрЕШЃЌдђЯћКФЕФбѕЦјЛЏКЯМлНЕЕЭЕФзмЪ§вВЯрЕШЃЌЯћКФ0.15molбѕЦјМДБъПіЯТЕФ3.36LЁЃ


 ПЊаФПьРжМйЦкзївЕЪюМйзївЕЮїАВГіАцЩчЯЕСаД№АИ
ПЊаФПьРжМйЦкзївЕЪюМйзївЕЮїАВГіАцЩчЯЕСаД№АИ УћЬтбЕСЗЯЕСаД№АИ
УћЬтбЕСЗЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЃЈ1ЃЉвбжЊЃКN2ЃЈgЃЉ+O2ЃЈgЃЉ=2NOЃЈgЃЉ; ЁїH=+180ЃЎ5 kJЁЄmol-1
4NH3ЃЈgЃЉ+5O2ЃЈgЃЉ=4NOЃЈgЃЉ+6H2OЃЈgЃЉЃЛЁїH=-905 kJЁЄmol-1
2H2ЃЈgЃЉЪЎO2ЃЈgЃЉ=2HOЃЈgЃЉЃКЁїH=--483ЃЎ6 kJЁЄmol-1
дђN2ЃЈgЃЉ+3H2ЃЈgЃЉ![]() 2NH3ЃЈgЃЉЕФЁїH=___________ЁЃ
2NH3ЃЈgЃЉЕФЁїH=___________ЁЃ
ЃЈ2ЃЉдквЛЖЈЬѕМўЯТЃЌНЋ2mol N2гы5mol H2ЛьКЯгквЛИі10 LЕФУмБеШнЦїжаЃЌЗДгІЧщПіШчЭМ1ЫљЪОЃК
ЂйЧѓ5minФкЕФЦНОљЗДгІЫйТЪvЃЈNH3ЃЉ______________ЃЛ
ЂкДяЕНЦНКтЪБNH3ЕФЬхЛ§ЗжЪ§ЮЊ______________________ЁЃ
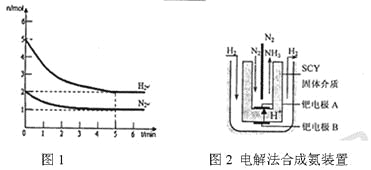
ЃЈ3ЃЉНќФъРДПЦбЇМвВЩгУИпжЪзгЕМЕчадЕФSCYЬеДЩЃЈФмДЋЕнH+ЃЉЮЊНщжЪЃЌгУЮќИНдкЫќФкЭтБэУцЩЯЕФН№ЪєюйЖрЦЗБЁФЄзіЕчМЋЃЌЪЕЯжСЫИпзЊЛЏТЪЕФЕчНтЗЈКЯГЩАБЃЈзАжУШчЭМ2ЃЉЁЃюйЕчМЋAЩЯЗЂЩњЕФЕчМЋЗДгІЪНЪЧ__________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдквЛЖЈЮТЖШЯТЃЌНЋЦјЬхXКЭЦјЬхY Иї0.16 molГфШы10 L КуШнУмБеШнЦїжаЃЌЗЂЩњЗДгІ
X(g) + Y(g) ![]() 2Z(g) HЃМ0ЃЌвЛЖЮЪБМфКѓДяЕНЦНКтЃЌЗДгІЙ§ГЬжаВтЖЈЕФЪ§ОнШчЯТБэЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ
2Z(g) HЃМ0ЃЌвЛЖЮЪБМфКѓДяЕНЦНКтЃЌЗДгІЙ§ГЬжаВтЖЈЕФЪ§ОнШчЯТБэЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ
t / min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
AЃЎЗДгІЧА2minЕФЦНОљЫйТЪv(Z)=2.0ЁС10ЈC5 mol/(LЁЄmin)
BЃЎЦфЫћЬѕМўВЛБфЃЌНЕЕЭЮТЖШЃЌЗДгІДяЕНаТЦНКтЧАv(Фц)ЃОv(е§)
CЃЎИУЮТЖШЯТДЫЗДгІЕФЦНКтГЃЪ§K=1.44
DЃЎЦфЫћЬѕМўВЛБфЃЌдйГфШы0.2 mol ZЃЌЦНКтЪБXЕФЬхЛ§ЗжЪ§діДѓ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊЪвЮТЪБЃЌ0.1mo1/LФГвЛдЊЫсHAдкЫЎжага0.1ЃЅЗЂЩњЕчРыЃЌЯТСаа№ЪіДэЮѓЕФЪЧЃК
A. ИУШмвКЕФpH=4 B. Щ§ИпЮТЖШЃЌШмвКЕФpHдіДѓ C. ДЫЫсЕФЕчРыЦНКтГЃЪ§дМЮЊ1ЁС10-7 D. гЩHAЕчРыГіЕФc(H+)дМЮЊЫЎЕчРыГіЕФc(H+)ЕФ106БЖ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПQЁЂRЁЂTЁЂWЫФжжЖЬжмЦкдЊЫидкдЊЫижмЦкБэжаЕФЮЛжУШчЭМЫљЪОЃЌЦфжаTЫљДІЕФжмЦкађЪ§гыжїзхађЪ§ЯрЕШЃЌЧыЛиД№ЯТСаЮЪЬтЃК
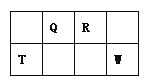
ЃЈ1ЃЉTЕФдзгНсЙЙЪОвтЭМЮЊ_______.
ЃЈ2ЃЉдЊЫиЕФЗЧН№ЪєадЮЊЃЈдзгЕФЕУЕчзгФмСІЃЉЃКQ______W(ЬюЁАЧПгкЁБЛђЁАШѕгкЁБ)ЁЃ
ЃЈ3ЃЉWЕФЕЅжЪгыЦфзюИпМлбѕЛЏЮяЕФЫЎЛЏЮяХЈШмвКЙВШШФмЗЂЩњЗДгІЃЌЩњГЩСНжжЮяжЪЃЌЦфжавЛжжЪЧЦјЬхЃЌЗДгІЕФЛЏбЇЗНГЬЪНЮЊ_____.
ЃЈ4ЃЉдзгађЪ§БШRЖр1ЕФдЊЫиЕФвЛжжЧтЛЏЮяAФмЗжНтЮЊЦфСэвЛжжЧтЛЏЮяBЃЌаДГіAЕФЕчзгЪН______.
ЃЈ5ЃЉRгаЖржжбѕЛЏЮяЃЌЦфжаМзЕФЯрЖдЗжзгжЪСПзюаЁЁЃдквЛЖЈЬѕМўЯТЃЌ2LЕФМзЦјЬхгы0.5LЕФбѕЦјЯрЛьКЯЃЌШєИУЛьКЯЦјЬхБЛзуСПЕФNaOHШмвКЭъШЋЮќЪеКѓУЛгаЦјЬхВаСєЃЌЫљЩњГЩЕФRЕФКЌбѕЫсбЮЕФЛЏбЇЪНЪЧ__________.
ЃЈ6ЃЉдк298KЯТЃЌQЁЂTЕФЕЅжЪИї1molЭъШЋШМЩеЃЌЗжБ№ЗХГіШШСПaKJКЭbKJЁЃгжжЊвЛЖЈЬѕМўЯТЃЌTЕФЕЅжЪФмНЋQДгЫќЕФзюИпМлбѕЛЏЮяжажУЛЛГіРДЃЌШєДЫжУЛЛЗДгІЩњГЩ3molQЕФЕЅжЪЃЌдђИУЗДгІдк298KЯТЕФЁїH =________kJ/mol(зЂЃКЬтжаЫљЩшЕЅжЪОљЮЊзюЮШЖЈЕЅжЪ)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЛЏбЇгУгяЖдЪТЪЕЕФБэЪіе§ШЗЕФЪЧЃЈ ЃЉ
A.ЬМЫсБШБНЗгЫсадЧПЃК2C6H5ONa+CO2+H2O=2C6H5OH+Na2CO3
B.ЪЕбщЪвгУТШЛЏТСШмвККЭАБЫЎжЦБИЧтбѕЛЏТСЃКAl3++3OH-=Al(OH)3Ё§
C.ЙЄвЕЩЯгУЕчНтЗЈжЦУОЃКMgCl2ЃЈШлШкЃЉ![]() Mg+Cl2Ёќ
Mg+Cl2Ёќ
D.ЯђNaOHШмвКжаЭЈШыЙ§СПЕФЖўбѕЛЏСђЃКSO2+2NaOH=Na2SO3+H2O
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдквЛУмБеШнЦїжаНјааЗДгІЃК2SO2(g)+O2(g) ![]() 2SO3(g)ЁЃвбжЊЗДгІЙ§ГЬжаФГвЛЪБПЬSO2ЁЂO2ЁЂSO3ЕФХЈЖШЗжБ№ЮЊ0.4mol/LЁЂ0.2mol/LЁЂ0.4mol/LЃЌЕБЗДгІДяЦНКтЪБЃЌПЩФмДцдкЕФЪ§ОнЪЧ
2SO3(g)ЁЃвбжЊЗДгІЙ§ГЬжаФГвЛЪБПЬSO2ЁЂO2ЁЂSO3ЕФХЈЖШЗжБ№ЮЊ0.4mol/LЁЂ0.2mol/LЁЂ0.4mol/LЃЌЕБЗДгІДяЦНКтЪБЃЌПЩФмДцдкЕФЪ§ОнЪЧ
A. SO2ЮЊ0.8mol/LЃЌO2ЮЊ0.4mol/L
B. SO2ЮЊ0.5mol/L
C. SO3ЮЊ0.8mol/L
D. SO2ЁЂSO3вЛЖЈОљЮЊ0.3mol/L
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЩшNAЮЊАЂЕТТоГЃЪ§ЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A.2L1mol/LNH4ClШмвККЌNH4+КЭCl-ОљЮЊ2NA
B.дкГЃЮТГЃбЙЯТЃЌ22gЖўбѕЛЏЬМКЌгаЙВгаЕчзгЖдзмЪ§ЮЊ2NA
C.0.1molOH-ЕФжЪзгЪ§гы0.1molH2OЕФЕчзгЪ§ОљЮЊNA
D.дкБъзМзДПіЯТЃЌ11.2LаСЭщжаЕФЬМдзгЪ§ЮЊ4NA
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊЃК101 kPaЪБЃЌ1molH2ЭъШЋШМЩеЩњГЩвКЬЌЫЎЃЌЗХГі285.8 kJЕФШШСПЃЛ1molCH4ЭъШЋШМЩеЩњГЩвКЬЌЫЎКЭCO2ЃЌЗХГі890.3 kJЕФШШСПЁЃЯТСаФмБэЪОШМЩеШШЕФШШЛЏбЇЗНГЬЪНЪЧ
A.CH4(g)+2O2(g)![]() CO2(g)+2H2O(l) ІЄH=890.3 kJ
CO2(g)+2H2O(l) ІЄH=890.3 kJ
B.CH4(g)+2O2(g)![]() CO2(g)+2H2O(l) ІЄH=+890.3 kJЁЄmol1
CO2(g)+2H2O(l) ІЄH=+890.3 kJЁЄmol1
C.CH4(g)+2O2(g)![]() CO2(g)+2H2O(g) ІЄH=890.3 kJЁЄmol1
CO2(g)+2H2O(g) ІЄH=890.3 kJЁЄmol1
D.H2(g)+![]() O2(g)
O2(g)![]() H2O(l) ІЄH=285.8 kJЁЄmol1
H2O(l) ІЄH=285.8 kJЁЄmol1
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com